Epmers
- 4839
- 1117
- Maksymilian Kępa
 Struktura epimeru. Źródło: Gabriel Bolívar
Struktura epimeru. Źródło: Gabriel Bolívar Jakie są epigierki?
Epmers Są to diaiaisomery, w których tylko jeden z jego centrów akwiralnych różni się od konfiguracji przestrzennej, w przeciwieństwie do enancjomerów, w których wszystkie centra akwiralne mają różne konfiguracje i reprezentują kilka obrazów spekulowych, które nie mogą nakładać się na jeden na drugie.
Reszta diasteroizomerów (na przykład izomery geometryczne) może mieć więcej niż dwa centra z różnymi konfiguracją. Stąd duży odsetek stereoizomerów to diiastoizomery.
Epmery występują często w węglowodanach: na przykład D-glikoza i d-manosa różnią się w C2, który jest pierwszym chiralnym atomem węgla.
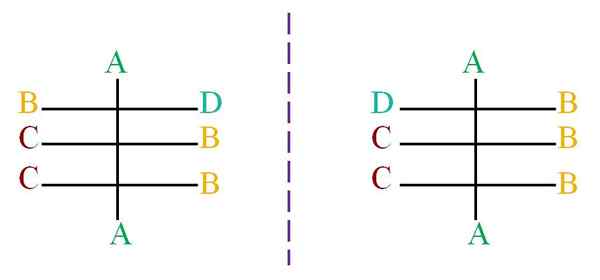
Załóżmy, że struktura z szkieletem czarnych atomów połączona z literami A, B, C i D (obraz doskonały).
Linia kropkowana reprezentuje lustro, co pokazuje, że momentem cząsteczek powyżej nie są enancjomerami, ponieważ wszystkie jej chiralne centra mają tę samą konfigurację, z wyjątkiem pierwszego centrum, połączonego z literami B i D.
Cząsteczka po lewej stronie ma literę D patrząc na prawą stronę, podczas gdy litera D prawej cząsteczki patrzy na lewą stronę. Aby wiedzieć, jaka konfiguracja każdego z nich musi być użyta do systemu (R-S) Cahn-Ingold-Prelog.
Charakterystyka śpiodników
- Główna cecha śpiarka leży tylko w centrum akwiralnym (lub stereogennym).
Zmiana przestrzennej orientacji D i B może powodować bardziej stabilne lub niestabilne konformery, to znaczy obroty prostych połączeń powodują dwa atomy lub grupy nieporęcznych atomów lub odejść.
Zatem epimer może być znacznie bardziej stabilny niż drugi. Ten, kto obraca swoje linki, generuje bardziej stabilne struktury, będzie epimerus z największą tendencją do tworzenia się w równowadze.
Może ci służyć: system niejednorodnyPowrót do liter, D i B może być bardzo nieporęczne, a C jest małym atomem. Tak więc bycie epimerem prawej jest bardziej stabilne, ponieważ D i C znalezione po lewej stronie dwóch pierwszych centrów cierpią z powodu mniejszych przeszkód sterycznych.
- Mikroskopowo staje się to charakterystyką dla pary rozważanych nabłonków.
- Makroskopowo różnice są zaakcentowane i kończą, na przykład, mając temperaturę topnienia, współczynniki załamania światła, różne widma NMR (oprócz wielu innych właściwości).
- W dziedzinie biologii i reakcji katalizowanych przez enzymy, to tam, gdzie epitetyki różnią się jeszcze bardziej. Jeden może być metabolizowany przez ciało, a drugi.
Szkolenie
Epmery powstają w reakcji chemicznej zwanej epimeryzacją. Jeśli obaj uosobienie nie różnią się dużym stopniem stabilności, ustalono równowagę epimeryzacji, która jest niczym więcej niż interkonwersją:
EPB EPA
Gdzie EPA jest epimer a i epb epimer. Jeśli jedno z nich jest znacznie bardziej stabilne od drugiego, będzie miało większą koncentrację i spowoduje tak zwane mutarrotacja. Innymi słowy, będzie mógł zmienić kierunek wiązki światła spolaryzowanego.
Epimeryzacja może nie być równowagą, a zatem jest nieodwracalna. W takich przypadkach uzyskuje się rankinę diasteroizomerów EPA/EPB.
Syntetyczna droga epitarów różni się w zależności od zaangażowanych odczynników, środków reakcji i zmiennych procesowych (stosowanie katalizatorów, ciśnienia, temperatury itp.).
Z tego powodu tworzenie każdej pary epitarów musi być badane indywidualnie od innych, każda z własnymi mechanizmami i systemami chemicznymi.
Może ci służyć: Zmniejszenie agenta: koncepcja, najsilniejsze, przykładyTautomeryzacja
Spośród wszystkich procesów formacji nabłonków dwudniowa tautomeryzacja można uznać za ogólny przykład.
Składa się z równowagi, w której cząsteczka przyjmuje formę ketonową (C = O) lub Innilicus (C-OH). Po przekonwertowaniu kształtu ketonicznego konfiguracja węgla sąsiadująca z grupą karbonylową (jeśli jest chiralna), generując kilka epitów.
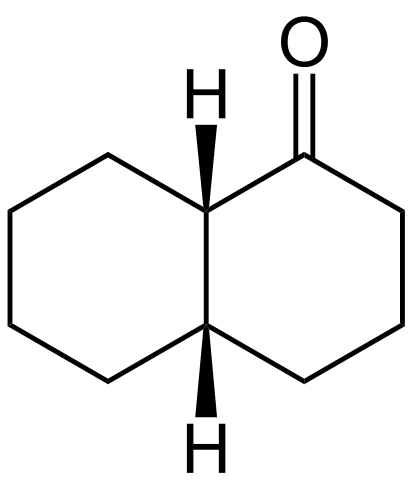
Przykładem wyżej wymienionych jest cis-dekalon i moment obrotowy trans-dekualonu.
 Struktura cis-decalona. Źródło: Wikimedia Commons
Struktura cis-decalona. Źródło: Wikimedia Commons Struktura cis-decalona pokazano powyżej. Atomy H znajdują się na górze dwóch pierścieni, podczas gdy w transalonie trans, jeden jest nad pierścieniami, a drugi poniżej.
Węgiel po lewej stronie grupy c = o jest centrum quiral, a zatem ten, który odróżnia odcinki.
Przykłady
Anomery glukozy
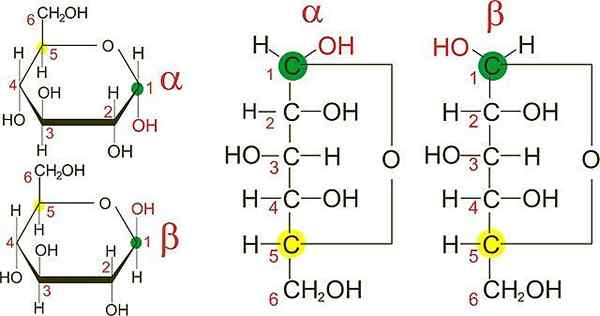 Anomery d-glukozy. Źródło: Wikimedia Commons
Anomery d-glukozy. Źródło: Wikimedia Commons Na lepszym obrazie masz furbenowe pierścienie dwóch anomerów D-glikozy: α i β. Z pierścieni można zauważyć, że grupy OH w węglu 1 znajdują się albo w tym samym kierunku sąsiedniego OH, w anomerie α, albo w przeciwnych kierunkach, jak w anomerie β.
Projekcje rybaka obu anomerów (po prawej stronie obrazu) robi różnicę między obiema epitemami jeszcze wyraźniejszymi, które z kolei są anomerami.
Jednak dwa anomery α mogą mieć różne konfiguracje przestrzenne w jednym z pozostałych węgli, a zatem nabłonki.
W C-1 projekcji Fishera dla anomeru α grupa OH „wygląda” po prawej.
Może ci służyć: Faraday ConstantIzomery mentolu
 Stereoizomery mentolu. Źródło: Wikimedia Commons
Stereoizomery mentolu. Źródło: Wikimedia Commons Na obrazie masz wszystkie stereoizomery cząsteczki mentolowej. Każda kolumna reprezentuje parę enancjomerów (ostrożnie obserwuj), podczas gdy szeregi odpowiadają diastereoizomerom.
Tak więc epitary muszą być tymi, które ledwo nie różnicują nic więcej niż w pozycji przestrzennej węgla.
(+)-mentol i (-)-neoisomentol to epiteres, a także cukrzycy (nie są w tej samej kolumnie).
Jeśli jest to szczegółowo obserwowane, zarówno w grupach -OH, jak i -ch3 Opuszczają płaszczyznę (nad pierścieniem), ale w (-)-neoisomentolu grupa izopropilowa również wskazuje na płaszczyznę.
Nie tylko mentol (+)-epimer (-)-neoisomentol, ale także (+)-neomentol. Ten ostatni różni się tylko tym, że grupa -ch3 wskazuje samolot. Inne epiteres to:
- (-)-izomentol i (-)-neomentol
- (+)-izomentol i (+)-neomentol
- (+)-neoisomentol i (-)-neomentol
- (+)-Neomentol i (-)-neoisomentol
Te stereoizomery stanowią praktyczny przykład wyjaśnienia pojęcia epitarek i widać, że z kilku diastereoizomerów wiele można zróżnicować tylko w jednym asymetrycznym lub chiralnym węglu.
Bibliografia
- Carey f. (2008). Chemia organiczna. MC Graw Hill.
- Epmers. Pobrano z klas.Uruguayeduca.Edu.Oh

