Entalpia reakcji, termochemia, ćwiczenia

- 4355
- 204
- Estera Wojtkowiak
entalpia reakcji Jest to funkcja termodynamiczna, która pozwala obliczyć zyskanie lub dostarczenie ciepła do reakcji chemicznej, pod warunkiem, że reakcja ta wystąpiła przy stałym ciśnieniu. Jest zdefiniowany jako energia wewnętrzna lub plus iloczyn ciśnienia p objętości V substancji zaangażowanych w reakcję chemiczną, jak następuje: H = u + p ∙ v
Dlatego entalpia ma wymiary energii, aw międzynarodowym systemie miar mierzonych w dżuli. Aby zrozumieć związek entalpii z ciepłem wymienionym w reakcji chemicznej, należy pamiętać o pierwszym prawie termodynamiki, które ustala: q = δu + w
 Rysunek 1. W spalaniu gazu entalpia maleje. Źródło: Pixabay
Rysunek 1. W spalaniu gazu entalpia maleje. Źródło: Pixabay Pierwsze prawo określa, że ciepło wymieniane w procesie termodynamicznym jest równe zmienności energii wewnętrznej substancji zaangażowanych w proces plus prace przeprowadzane przez te substancje w tym procesie.
W dowolnym procesie Work są obliczane na podstawie następującej relacji:

W poprzednim wyrażeniu VI to początkowa objętość, VF końcowa objętość i p ciśnienie. Jeśli proces zostanie przeprowadzony pod stałym ciśnieniem P, wówczas wynikowa praca będzie:
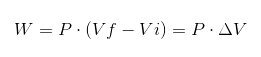
Gdzie δv jest zmiennością objętości.
[TOC]
Definicja
Reakcje chemiczne to procesy termodynamiczne, które na ogół występują pod stałym ciśnieniem i bardzo często pod ciśnieniem atmosferycznym. Ten rodzaj procesów termodynamicznych nazywa się „izobaryczny”, ponieważ występuje pod stałym ciśnieniem.
W takim przypadku pierwsze prawo termodynamiki można napisać w ten sposób:
QP = δu + p ∙ δv
Gdzie QP wskazuje, że ciepło zostało wymienione pod stałym ciśnieniem. Jeśli uzyskano definicję entalpii h = u + p ∙ v, to:
QP = δH
Stamtąd musisz zmienić pozytywną entalpię wskazuje na reakcję, która wzięła ciepło ze środowiska. To jest reakcja endotermiczna.
Może ci służyć: Ton: Transformacje, równoważniki i ćwiczenia rozwiązanePrzeciwnie, jeśli zmiana entalpii jest ujemna, jest to reakcja egzotermiczna.
W rzeczywistości słowo entalpia pochodzi od greckiego słowa Entalpien, którego znaczenie to „ciepło”.
Często entalpia nazywana jest również ciepłem. Ale musi być jasne, że to nie to samo co ciepło, ale to wymiana ciepła podczas procesu termodynamicznego zmienia entalpię.
Relacja cieplna
W przeciwieństwie do ciepła, entalpia jest funkcją stanu. Po obliczaniu zmiany entalpii różnica dwóch funkcji, które zależą wyłącznie od statusu systemu, takiego jak energia wewnętrzna i objętość, jest obliczane.
ΔH = δu + p ∙ δv
Jak w reakcji ciśnienie pozostaje stałe, entalpia reakcji jest funkcją stanu, która zależy tylko od energii wewnętrznej i objętościowej.
W reakcji chemicznej entalpia odczynników można zdefiniować jako sumę oświadczenia każdego z nich; i produkty jako suma entalpii wszystkich produktów.
Zmiana entalpii w reakcji jest różnicą zmiany produktów, z wyjątkiem odczynników:

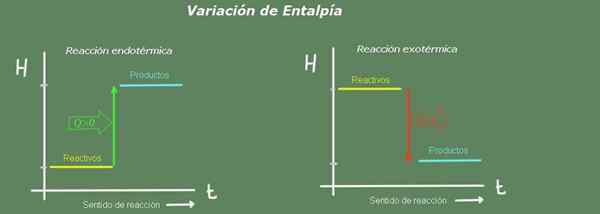 Rysunek 2. Schemat entalpii. Źródło: Self Made.
Rysunek 2. Schemat entalpii. Źródło: Self Made. W reakcji endotermicznej entalpia produktów jest większa niż w przypadku odczynników; Oznacza to, że reakcja pobiera ciepło ze środowiska. Przeciwnie, w reakcji egzotermicznej entalpia odczynników jest większa niż w przypadku produktów, ponieważ reakcja nadaje ciepło środowisku.
Standardowa entalpia
Ponieważ zmiana entalpii w reakcji chemicznej może zależeć od ciśnienia i temperatury, zwyczajowe jest zdefiniowanie standardowych warunków reakcji:
Może ci służyć: krzywa kalibracji: po co to zrobić, jak to zrobić, przykładyStandardowa temperatura reakcji: 25 ° C.
Standardowe ciśnienie reakcji: 1 atm = 1 bar.
Standardowa entalpia jest oznaczona w następujący sposób: H °
Termochemia
W równaniu termochemicznym nie tylko ma znaczenie odczynniki i produkty, zmienność entalpii również ma znaczenie. Entalpia jest rozumiana jako reakcja na jej zmianę, która miała miejsce w tym samym.
Jako przykład zobaczmy następujące reakcje:
2 H2 (gaz) + O2 (gaz) → 2 H2O (ciecz); ΔH ° = -571,6 kJ (egzotermiczny).
H2 (gaz) + (½) O2 (gaz) → H2O (ciecz); ΔH ° = -285,8 kJ (egzotermiczny).
2 H2O (ciecz) → 2 H2 (gaz) + O2 (gaz); ΔH ° = +571,6 kJ (endotermiczny).
Entalpia to obszerna kwota termodynamiczna
Jeśli warunki równania chemicznego są pomnożone lub podzielone przez określony czynnik, wówczas entalpia jest pomnożona lub podzielona.
Jeśli zainwestowana jest reakcja, zainwestowano również znak entalpii reakcji.
Rozwiązane ćwiczenia
-Ćwiczenie 1
C2H2 Acetylen Gas uzyskuje się z reakcji węglika wapnia CAC2, która pojawia się w granulowany sposób z wodą w środowisku i ciśnieniu środowiskowym.
Jako dane istnieją entalpie tworzenia odczynników:
ΔH ° (CAC2) = -59,0 kJ/mol
ΔH ° (H20) = -285,8 kJ/mol
I entalpia tworzenia produktu:
ΔH ° (C2H2) = +227,0 kJ/mol
ΔH ° (Ca (OH) 2) = -986,0 kJ/mol
Znajdź standardową entropię reakcji.
Rozwiązanie
Pierwszą rzeczą jest podniesienie zrównoważonego równania chemicznego:
CAC2 (S) + 2H20 (L) → Ca (OH) 2 (s) + C2H2 (g)
A teraz entalpie odczynników, produktów i reakcji:
- Odczynniki: -59,0 kJ/mol -2 ∙ 285,8 kJ/mol = -630,6 kJ/mol
- Produkty: -986,0 kJ/mol + 227,0 kJ/mol = -759 kJ/mol
Może ci służyć: jakie są wektory koplanares? (Z rozwiązanymi ćwiczeniami)- Reakcja: ΔH ° = -759 kJ/mol -( -630 kJ/mol) = -129 kJ/mol
Jest to reakcja egzotermiczna.
-Ćwiczenie 2
Kiedy 1 litr acetylenu płonie w standardowych warunkach, ile ciepła się odłącza?
Rozwiązanie
Taka jest reakcja spalania acetylenu, jest taka:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (l)
Potrzebujemy entalpii szkolenia produktów:
ΔH ° (CO2) = -393,5 kJ/mol
ΔH ° (H2O (L)) = -285,8 kJ/mol
Obliczanie entalpii
Za pomocą tych danych możemy obliczyć entalpię produktów:
ΔH ° (produkty) = 2*(-393,5 kJ/mol) + (-285,8 kJ/mol) = -1072,8 kJ/mol
I entalpia formacji odczynników:
ΔH ° (C2H2) = 227,0 kJ/mol
ΔH ° (O2) = 0,0 kJ/mol
Entalpia odczynników będzie:
227,0 kJ/mol + (5/2)* 0,0 = 227,0 kJ/mol
Entalpia reakcji molowej będzie wtedy: δH ° (produkty) - δH ° (odczynniki) = -1072,8 kJ/mol - 227,0 kJ/mol = -1299,8 kJ/mol
Entalpia spalania
Teraz musimy wiedzieć, ile moli acetylenu jest litrem acetylenu w standardowych warunkach. W tym celu wykorzystamy równanie stanu idealnego gazu, z którego wyczyścimy liczbę moli.
Liczba moli n = p*v/(r*t)
P = 1 atm = 1,013 x 10⁵ pa
V = 1 l = 1,0 x 10^-3 m3
R = 8,31 j/(mol*k)
T = 25 ° C = 298,15 K
N = 0,041 mol
Entalpia spalania 1 litra acetylenu wynosi 0,041 mol * (-129,8 kJ/mol) = -53,13 kJ
Znak ujemny wskazuje, że jest to reakcja egzotermiczna, która wydziela 53,13 kJ = 12,69 kcal.
Bibliografia
- Castaños e. Entalpia w reakcjach chemicznych. Odzyskane z: lidiaconlachimica.WordPress.com
- Termochemia. Entalpia reakcji. Źródło: Zasoby.Edukacja.Jest
- Termochemia. Definicja standardowej entalpii reakcji. Odzyskane z: QuimiTube.com
- Wikipedia. Standardowa entalpia reakcji. Odzyskane z: Wikipedia.com
- Wikipedia. Entalpia treningowa. Odzyskane z: Wikipedia.com
- « Względne wzory błędów, sposób ich obliczania, ćwiczenia
- Jaki jest wysiłek zadania i jak je uzyskać? »

