Struktura enolazy, mechanizm działania, funkcje
- 4649
- 529
- Eugenia Czapla
Enolaza Jest to enzym odpowiedzialny za przeprowadzenie konwersji D-2-fosfoglikanu (2PGA) w fosfoenolopirogronian (PEP) w glikolizy i odwrotnej reakcji w glukoneogenezie, dwie trasy metaboliczne, które są częścią metabolizmu energii komórkowej.
Decyzja o katalizowaniu tej reakcji w jednym lub innym kierunku zależy od dostępu, jaki ma komórka do glukozy. To znaczy potrzeb dostosowania metabolizmu do degradacji lub syntezy w celu uzyskania energii. Niezbędne do realizacji jego istotnych procesów.
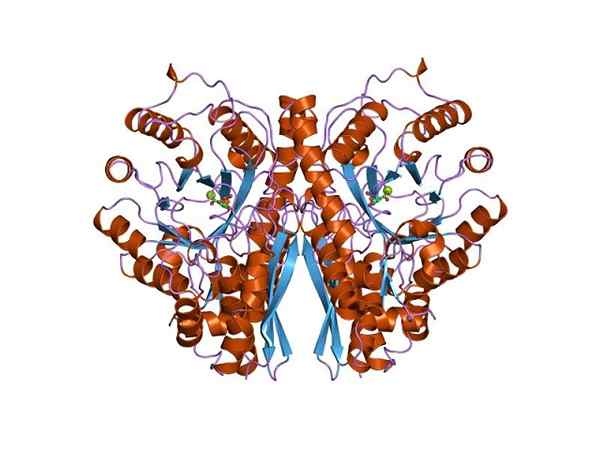
 Trzy -wymiarowa struktura enolasy. Autor: Jawahar Swaminathan i personel MSD w Europejskim Instytucie Bioinformatyki [domena publiczna (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons.
Trzy -wymiarowa struktura enolasy. Autor: Jawahar Swaminathan i personel MSD w Europejskim Instytucie Bioinformatyki [domena publiczna (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons. Ponieważ obie drogi metaboliczne należą do centrum centralnego metabolicznego drzewa żywych istot, nie jest dziwne, że sekwencja aminokwasowa tego białka jest zachowana w archeae, bakteriach i eukariotach. I dlatego przedstawiają podobne właściwości katalityczne.
Lokalizacja enolazy w komórce jest ograniczona do cytosolu, przedziału, w którym odbywa się zarówno glikoliza (zwana również glikolizą), jak i glukoneogenezę w większości organizmów.
Jednak został również wykryty w innych przedziałach komórkowych, takich jak błona plazmatyczna wielu komórek rakowych i komórek. Tam wydaje się być zaangażowany w ułatwianie procesów rozpowszechniania komórek, zupełnie inną funkcją od jej klasycznej funkcji.
Enzymy zdolne do wykonywania więcej niż jednej funkcji, podobnie jak enolaza, są znane jako enzymy światła księżyca.
[TOC]
Struktura
Struktura czwartorzędowa Linusa lub nie w jego ligandach została określona w dużej liczbie osób prokariotycznych i eukariotycznych.
Każda monomer przedstawia dwie domeny: mała domena amino-końcowa i większa domena karboksylowa. N-końcowa domena składa się z trzech arkuszy α i czterech β. Podczas gdy C-końcowy składa się z ośmiu arkuszy β, które naprzemiennie między nimi tworząc lufę β, która jest otoczona ośmiu śmigieł α.
Ponadto w każdym monomerie znajdują się dwa miejsca związkowe dla kationów Dyspolitalnych, które zostały nazwane „miejscem konformacyjnym” i „miejscem katalitycznym”. Pierwszy nie jest bardzo selektywny i może dołączyć do szerokiej gamy białkowych kationów przy braku podłoża.
Może ci służyć: sfingolipidy: co to jest, cechy, funkcje, syntezaPodczas gdy drugi wiąże się z jonami po połączeniu substratu do enzymu. Związek jonów do obu miejsc jest niezbędny do kontynuowania reakcji.
Na koniec należy wspomnieć, że w homodimerach monomery łączą się, utrzymując orientację równoległą. Dlatego aktywne miejsce jest ograniczone do regionu centralnego utworzonego przez wspomniany związek.
Jednak tylko jeden z dwóch monomerów uczestniczy w katalizie. To wyjaśnia, że zdolność monomerów do reakcji w warunkach eksperymentalnych.
Mechanizm akcji
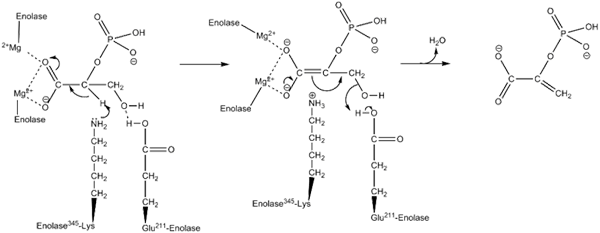 Mechanizm działania stosowany przez inolazę enzymu. Autor: Kthompson08 w języku angielskim Wikipedia [domena publiczna (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons.
Mechanizm działania stosowany przez inolazę enzymu. Autor: Kthompson08 w języku angielskim Wikipedia [domena publiczna (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons. Badania strukturalne, a także te, które pozwoliły na określenie cech kinetycznych i fizykochemicznych enolasy, pozwoliły nam zrozumieć ich mechanizm działania.
Sposób, w jaki enzym wykonuje kataliza reakcji, jest dość interesujący. Chociaż zaangażowany jest pojedynczy substrat, uporządkowane mechanizm sekwencyjny jest tym, który został zaproponowany.
Zaczyna się od związku jonu Mg2+ do miejsca konformacyjnego jednego z monomerów. Ciągłe wraz z połączeniem podłoża do miejsca aktywnego, a następnie połączenia drugiego jonu w miejscu katalitycznym i kończy się szybkim uwalnianiem produktu po przeprowadzeniu reakcji. W tym momencie MG2+ pozostaje powiązany z miejscem konformacyjnym.
Wzdłuż tych samych linii, aby sprzyjać realizacji reakcji średniej enzymu w pierwszej kolejności generacji pośrednikach Carbanion, eliminując proton węgla 2 2PGA. To robi dzięki działaniu podstawowych pozostałości aminokwasowych.
Sekwencyjnie usuwanie hydroksylowego węgla 3 odbywa się przez działanie kwaśnej pozostałości z enzymu. W tym momencie związek obu węgli jest przeprowadzany za pomocą podwójnej wiązania tworzących PEP. W ten sposób reakcja jest zakończona.
Może ci służyć: Monera Kingdom: Charakterystyka, klasyfikacja i przykładyFunkcje
Wiele badanych enzymów jest w stanie wykonywać szeroką gamę funkcji niezwiązanych z ich „klasyczną funkcją” w różnych przedziałach komórkowych. Te enzymy zostały nazywane enzymami „księżyca”.
W tym sensie enolaza można uznać za enzym księżycowe, ponieważ do tej pory przypisano liczne funkcje przeciwne ich klasycznej funkcji zarówno w bakteriach, jak i eukariotach.
Niektóre z tych funkcji są następujące:
- Uczestniczyć w utrzymaniu postaci komórkowej, a także w ruchu pęcherzyku podczas interakcji z białkami cytoszkieletu.
- W jądrze komórek ssaków działa jako czynnik transkrypcyjny, który reguluje ekspresję genów związanych z proliferacją komórek. Współpracować przy utrzymaniu stabilności RNM w degradacji w bakteriach.
- W patogenach, takich jak Streptococcus pneumoniae I Trypanosoma cruzi, Wydaje się, że działa jako ważny czynnik wirulencji.
- Stwierdzono również to w Streptococcus pyogenes, Enolaza jest wydalana do zewnątrzkomórkowego pożywki ułatwiającej degradację tkanki i unikanie systemu gospodarza.
- Na powierzchni komórek nowotworowych wyraża się to przez zwiększenie przerzutów.
Enolaza i jej związek z mechanizmami rozprzestrzeniania komórek
Liczne patogeny, a także komórki nowotworowe, wyrażają w błonie lub wydalały proteazy pożywki pozakomórkowej zdolne do poniżania białek białkowych.
Ta pojemność pozwala tym komórkom przełamać tkanki i szybko rozprzestrzeniać się w całym organizmie gospodarza. Faworyzując w ten sposób unikanie układu odpornościowego, a tym samym ustanowienie infekcji.
Nawet gdy enolasa nie ma aktywności proteazy, uczestniczy w rozpowszechnianiu wielu patogenów w swoim gospodarze, a także komórek nowotworowych podczas CealStastasis.
To osiąga to dzięki faktowi, że jest wyrażany na powierzchni tych komórek działających jako receptor plazminogenu. Ten ostatni jest Zimogenem-Prototeazę Serinową znaną jako plazmininian, który jest częścią układu fibrynolitycznego i działa degradujące białka macierzy pozakomórkowej.
Dlatego enolaza wyrażona na powierzchni jest strategią, którą komórki te nabyły w celu ustalenia infekcji i pomyślnego rozprzestrzeniania się.
Może ci służyć: specjacja sympatryczna: koncepcja, cechy i przykładyTa strategia składa się z dwóch procesów:
- Unikanie układu odpornościowego gospodarza. Ponieważ, gdy komórki te z białka gospodarza są powlekane, są one ignorowane przez komórki układu odpornościowego, które rozpoznają patogeny niezwiązane z Patogenami.
- Po rozprzestrzenianiu się plazminogenu w plazminnianie po akcji. Którego udział w degradacji białek macierzy pozakomórkowej, następnie ułatwia szybkie i skuteczne rozpowszechnianie.
Bibliografia
- Avilan L, Gualdron-Lopez M, Quiñones W, González-González L, Hannaert V, Michels Paa, Concepción JL. Eenolaza: kluczowy gracz w metabolizmie i prawdopodobny współczynnik wirulencji Trypanosomatid Passites-Perspectives do jego zastosowania jako cel terapeutyczny. Badania enzymatyczne. 2011 Vol. Artykuł ID932549, 14 stron.
- Bhowmick I, Kumar N, Sharma S, Coppens I, Jarori GK, Plasmodium falciparum enoosoaza: ekspresja ekspresji i lokalizacji podrzędnej. Malaria Journal. 2009; 8 (1). Artykuł 179.
- Dzień I, Peshavaria M, Quinn GB, różnicowy zegar molekularny w ewolucji izoproteiny enoaza. Journal of Molecular Evolution. 1993; 36 (6): 599-601.
- Torre-Scuder E, Manzano-Román R, Pérez-Sánchez R, Siles-Lucas M, Oleaga A. Klonowanie i charakterystyka enolaazy o powierzchni wiążącej plazminogen Schistosoma bovis. Parasytologia weterynaryjna. 2010; 173: 73-84.
- Dinovo EC, Boyer PD. Sondy izotopowe mechanizmu reakcji enolazy. Kursy wymiany izotopu początkowego i równorzędnego: Pierwotne i Secandary Isotope Effects. J Biol Chem. 1971; 246 (14): 4586-4593.
- Kaberdin VR, Lin-Chao, rozwikłanie nowych ról dla drobnych elementów E. Degradutacja coli RNA. Biologia RNA. 2009; 6 (4): 402-405.
- Keller A, Peltzer J, Carpentier G. Interakcje enolów. Biochimica et biophysica acta. 2007; 1770 (6): 919-926.
- Lung J, Liu KJ, Chang JY, Leu SJ, Shih NY. MBP-1 jest efektywnie kodowany przez alternatywny transkrypt genu Enri1 Buttranslacyjnie regulowany przez przesunięcie białka zależne od proteasomu. FEBS Journal. 2010; 277 (20): 4308-4321.
- Pancholi v. Wielofunkcyjna α-enolaza: jej rola w chorobach. Nauk o życiu komórkowym i molekularnym. 2001; 58 (7): 902-920.
- Poyner RR, Cleland WW, Reed GH. Rola metalu INS w katalizie przez enolazę. Uporządkowany mechanizm kinetyczny dla pojedynczego enzymu substratowego. Biochemia. 2001; 40: 9008-8017.
- Segovia-Gamboa NC, Chávez-Munguía B, Medina-Flores A, Entamoeba najeżdża, Proces enolazy i enolaza. Eksperymentalna pasożytologia. 2010; 125 (2): 63-69.
- Tanaka M, Sugisaki K, Nakashima K, Włączanie poziomów tłumaczonych mRNA dla izozymów enoazowych podczas rozwoju mięśnia szkieletowego pisklęcia. Biochemiczna i biofizyczna komunikacja badań. 1985; 133 (3): 868-872.

