Potrójna kowalencyjna więź
- 1062
- 256
- Matylda Duda
Wyjaśniamy, co to jest potrójne link, jego cechy i podajemy kilka przykładów
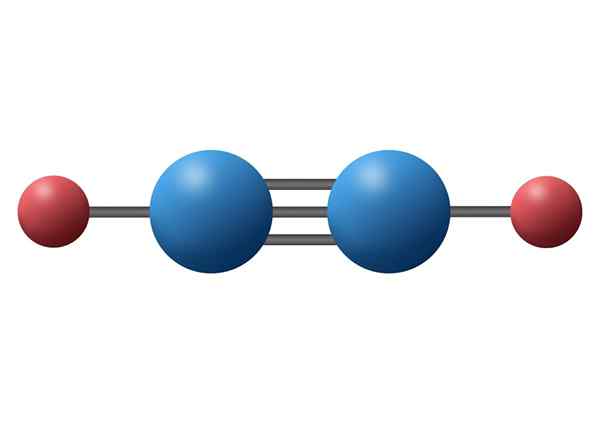 Cząsteczka acetylenu (C2H2) z potrójnym wiązaniem między dwoma atomami węgla
Cząsteczka acetylenu (C2H2) z potrójnym wiązaniem między dwoma atomami węgla Co to jest potrójnie kowalencyjny link?
Potrójne kowalencyjne obligacje Są to powiązania chemiczne, w których dwa atomy mają trzy pary elektronów. Innymi słowy, są to kowalencyjne wiązania utworzone przez sześć elektronów walencyjnych, które obracają się wokół dwóch atomów.
Istnieje wiele związków chemicznych, które zawierają potrójne łącza. Na przykład związki organiczne, takie jak alkiny, zawierają potrójne wiązania kowalencyjne C-C. Nitrile charakteryzują się również posiadaniem grupy zawierającej węgiel związany z azotem za pomocą potrójnego wiązania kowalencyjnego C-N. Inne związki nieorganiczne, takie jak azot molekularny w powietrzu, zawierają również potrójne wiązania kowalencyjne.
Posiadanie 6 elektronów obracających się wokół dwóch jąder daje potrójne łącza wiele szczególnych charakterystyk. Zarówno kształt cząsteczek, które je zawierają, jak i reakcje chemiczne, w których mogą uczestniczyć, różnią się od podwójnych lub prostych wiązań.
Triple Kowalencyjne Charakterystyka łącza
Są tworzone przez 6 elektronów
Wiązania te są tworzone przez 6 elektronów i powstają, gdy każdy z dwóch atomów obejmuje trzy zniknięte elektrony z drugim. To jest powód, dla którego nazywane są potrójnymi linkami, ponieważ mają potrójną liczbę elektronów prostej kowalencyjnej więzi.
Mają łącze Sigma (σ) i dwa łącza PI (π)
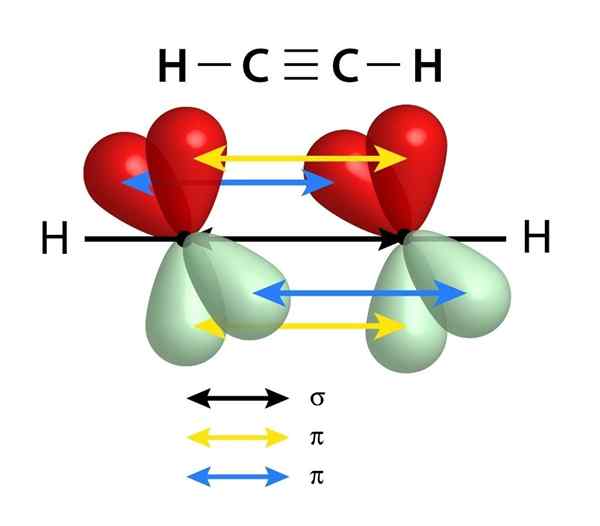 Schemat linków, które tworzą potrójne połączenie między dwoma atomami węgla. Czarna strzałka środka reprezentuje łącznik Sigma, podczas gdy żółty i niebieski reprezentuje każdy z dwóch wiązań PI
Schemat linków, które tworzą potrójne połączenie między dwoma atomami węgla. Czarna strzałka środka reprezentuje łącznik Sigma, podczas gdy żółty i niebieski reprezentuje każdy z dwóch wiązań PI Podobnie do podwójnych wiązań, potrójne łącza są również tworzone przez link sigma, który przechodzi przez środek linii, który dołącza do dwóch połączonych atomów. Jednak w przeciwieństwie do podwójnych linków, które mają jedno, potrójne linki mają dwa łącza PI oprócz linku Sigma.
Może ci służyć: chlorek miedzi (I) (CUCL): Struktura, właściwości, zastosowaniaPrawie zawsze tworzą liniowe związki
Gdy dwa atomy węgla tworzą potrójne połączenie, każdy z nich nadal ma możliwość utworzenia dodatkowego prostego związku z innym atomem (ponieważ węgiel może wytworzyć łącznie 4 wiązania).
W takich przypadkach oba dwa węgle i pozostałe dwa przymocowane do nich atomy utworzą linię prostą. Ta forma, którą nabywa cząsteczka nazywa się geometrią liniową.
Są najsilniejszymi kowalencyjnymi więziami
Porównując potrójne powiązania między dwoma atomami z podwójnymi i prostymi wiązaniami między tymi samymi atomami, obserwuje się, że potrójne łącza są zawsze silniejsze niż inne rodzaje wiązania kowalencyjnego. Oznacza to, że trudniej jest złamać potrójne link niż podwójne lub proste.
Wynika to z faktu, że ponadto konieczność złamania łącza Sigma (która jest również obecna zarówno w wiązaniach prostych, jak i podwójnych), nie trzeba złamać (jak w podwójnych linkach), ale dwa dodatkowe wiązania PI.
Są krótsze niż podwójne wiązania lub takie proste
Z powodu tego samego faktu, że są silniejszymi linkami, potrójne linki zarządzają.
Reprezentują dwie nienasycenie
Każdy węgiel z potrójnym wiązaniem będzie miał tylko dodatkowy związek z innym atomem. Oznacza to, że taki węgiel byłby powiązany tylko z dwoma atomami, zamiast czterech, więc ma mniej wodoru, niż mógłby mieć, gdyby powstał tylko proste wiązania.
Może ci służyć: heptano (C7H16): struktura, właściwości i zastosowaniaNazywa się to nienasyceniem, a związki z potrójnymi ogniwami mają dwa nienasycenie, ponieważ każdy z dwóch węgli pasowałby do 2 dodatkowych hydrogenów, jeśli nie dla potrójnego łącza.
Są sztywnymi linkami
Podobnie jak podwójne wiązania, potrójne linki są sztywne i trudne do zginania lub skręcania. Wynika to zarówno z większej siły łącza, jak i na najniższej długości.
Mogą działać jak bazy
Niektóre związki z potrójnymi łączami mogą używać elektronów PI wspomnianego linku do łączenia lub zaakceptowania jonów H+, Dlatego działając jako podstawy.
Mogą je uwodować, aby podać podwójne lub proste linki
Nienaturacja potrójnego łącza można usunąć poprzez zerwanie wiązań PI i dodanie hydrogenów do dwóch węgli. Nazywa się to uwodornieniem. Jeśli dodana zostanie tylko cząsteczka wodoru do potrójnego wiązania, stanie się ona podwójnym wiązaniem. Jeśli zostaną dodane dwie cząsteczki wodoru, stanie się to proste wiązanie.
Przykłady potrójnych kowalencyjnych linków
Cząsteczka azotu (n2)
Cząsteczka azotu zawiera potrójne wiązanie kowalencyjne między dwoma atomami azotu. Każdy atom dzieli trzy walencyjne elektronę zniknęły z drugim, a każda nowa para elektronów staje się wiązaniem sigma lub jednym z dwóch wiązań PI, które posiada cząsteczka.
 Cząsteczka azotu
Cząsteczka azotu W tym przypadku zarówno dwa atomy azotu, jak i nietknięte elektrony, które każde z nich znajdują się wzdłuż linii prostej.
Właściwy (alkin wzoru C3H4)
Właściwe jest druga najprostsza alkin. Ten związek składa się z trzech węzłów, z których dwa są połączone przez potrójne kowalencyjne połączenie.
Może ci służyć: nienasycone węglowodory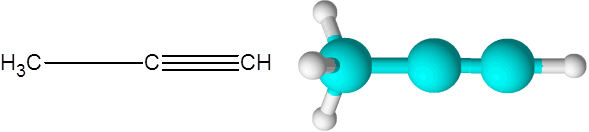 Cząsteczka propino
Cząsteczka propino Tutaj możesz również zobaczyć, że trzy węgle i ostatni atom wodoru (ten po prawej) tworzy linię prostą. W modelu można również zauważyć, że prosty link C-C jest dłuższy niż link C-C C-C.
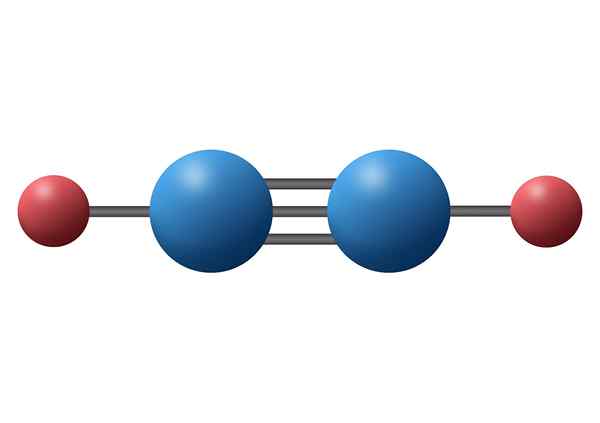
Tlenek węgla (CO)
Tlenek węgla jest toksycznym gazem nieorganicznym, który ma ujemny atom węgla i dodatni tlen połączony za pomocą potrójnego wiązania kowalencyjnego. W tym przypadku jest to wiązanie polarne, ze względu.
 Cząsteczka tlenku węgla
Cząsteczka tlenku węgla

