Podwójna kowalencyjna więź

- 1734
- 32
- Maksymilian Kępa
Wyjaśniamy, czym jest podwójna kowalencyjna więź, jej cechy i podajemy kilka przykładów
 Eteno lub cząsteczka etylenu. Jest to typowy przykład podwójnego kowalencyjnego wiązania między dwoma atomami węgla
Eteno lub cząsteczka etylenu. Jest to typowy przykład podwójnego kowalencyjnego wiązania między dwoma atomami węgla Co to jest podwójna kowalencyjna więź?
Podwójne wiązania kowalencyjne Są to powiązania chemiczne, w których dwa atomy mają dwie pary elektronów. Innymi słowy, są to kowalencyjne wiązania utworzone w sumie cztery elektron walencyjny, które obracają się wokół dwóch atomów.
Podwójne łącza są bardzo powszechne w związkach organicznych. Na przykład wszystkie alkeny mają podwójne wiązanie węglowe. Wiele innych grup funkcjonalnych, takich jak aldehydy, ketony, kwasy karboksylowe i amidki, ma również podwójne wiązania kowalencyjne między węglem a tlenem. Inne, takie jak imine, mają podwójne wiązania kowalencyjne c = n.
Podwójne linki mają wiele cech, które odróżniają je od innych rodzajów wiązań kowalencyjnych, takich jak proste linki i potrójne linki. Różnią się one w postaci cząsteczek, które je zawierają, w długości i sile łącza oraz inne cechy związane z ich właściwościami chemicznymi.
Podwójne kowalencyjne charakterystyki łącza
Są tworzone przez 4 elektrony
Powód, dla którego podwójne wiązania są, ponieważ zawierają podwójne elektrony prostego wiązania kowalencyjnego, które powstają, gdy dwa atomy mają dwa elektrony walencyjne. Oznacza to, że każde podwójne wiązanie zawiera 4 elektrony.
Są one tworzone przez łącze sigma (σ) i łącze PI (π)
Z 4 elektronów, które tworzą podwójne wiązanie, 2 z nich idzie między jednym atomem a drugim, przechodząc przez środek dwóch. Ta para elektronów nazywa się elektronami sigma, ponieważ tworzą wiązanie sigma (σ).
Druga para elektronów unosi się nad i poniżej dwóch atomów, tworząc rodzaj kanapki. Te elektrony są nazywane elektronami pi i tworzą łącze PI (π).
Może ci służyć: chlorobenzen (C6H5CL)Razem łącze Sigma i łącze PI tworzą podwójną kowalencyjną wiązanie.
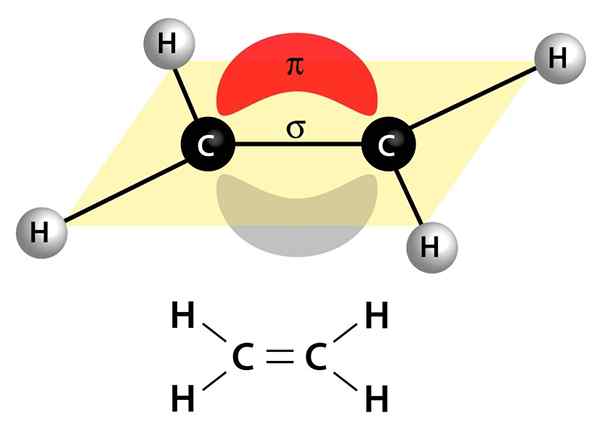 Ten obraz pokazuje dwa łącza, które składają się na podwójne wiązanie: link PI, który pojawia się jako czerwona i szara chmura, która jest powyżej i pod cząsteczką, oraz link sigma, który jest linią, która łączy oba jądra przez centrum
Ten obraz pokazuje dwa łącza, które składają się na podwójne wiązanie: link PI, który pojawia się jako czerwona i szara chmura, która jest powyżej i pod cząsteczką, oraz link sigma, który jest linią, która łączy oba jądra przez centrum Mogą być polarne lub apolarne
W zależności od elektroonywatywności atomów zjednoczonych za pomocą podwójnego wiązania kowalencyjnego, może to być polarne lub apolarne.
Na przykład podwójna kowalencyjna więź C = c Będzie to połączenie apolarne, ponieważ oba atomy są takie same i mają tę samą elektrooniczność. Zamiast tego podwójna kowalencyjna więź C = O Będzie polarny, ponieważ tlen jest znacznie bardziej elektroonywalny niż węgiel.
Są silniejsze niż proste linki
Łamanie podwójnego wiązania jest trudniejsze niż złamanie prostego związku między tymi samymi dwoma atomami. Wynika to z faktu, że aby złamać podwójne wiązanie, zarówno link Sigma (który jest równy prostemu łącze), jak i łącze PI muszą zostać zepsute. Ponieważ dwa łącza muszą być złamane zamiast jednego, podwójne wiązanie jest silniejsze niż proste.
Są słabsze niż potrójne linki
W porównaniu z potrójnym łączem podwójne wiązanie jest słabsze i łatwiejsze do zerwania. Powód jest taki sam jak wcześniej, tylko to, że w tym przypadku podwójna wiązanie ma mniej linków niż zerwanie w porównaniu z potrójnym łączem.
Są krótsze niż proste linki
Będąc silniejszymi linkami niż proste linki, podwójne wiązania są w stanie przybliżyć połączone atomy bliżej niż proste linki niż proste linki. Z tego powodu, jeśli podwójny łącze C = C jest porównywany z prostym łączem C-C, pierwszy jest zawsze krótszy niż drugi.
Może ci służyć: tiosiarczan sodu (Na2S2O3)Są dłuższe niż potrójne linki
Ponownie, gdy link potrójnego jest silniejszy niż podwójny link, link potrójnego jest krótszy. Oznacza to, że podwójne wiązania kowalencyjne są dłuższe niż potrójne.
Są sztywnymi linkami.
Proste wiązania kowalencyjne są dość elastyczne, a także mogą się obracać. Z drugiej strony podwójne wiązania są sztywne, nie są elastyczne i nie można ich obrócić, ponieważ wspomniany powyżej łącze PI zostałby zepsuty.
Reprezentują nienasycenie
Cząsteczka z podwójnym wiązaniem będzie miała dwa mniej powiązane atomy wodoru niż mogła. Z tego powodu mówi się, że podwójne wiązanie reprezentuje nienasycenie (każde nienasycenie odpowiada 2 hydrogenom).
Tworzą płaskie cząsteczki w kształcie trójkąta
Atom węgla, który tworzy podwójne kowalencyjne wiązanie i dwa inne proste wiązania, zawsze tworzy płaską cząsteczkę, w której trzy wiązania wskazują na końce trójkąta. Ta forma nazywa się płaską geometrią trygonalną.
Przykłady podwójnych kowalencyjnych wiązań
Link C = C w etylen
Etylen jest jednym z najprostszych przykładów podwójnego wiązania kowalencyjnego, w tym przypadku między dwoma atomami węgla.
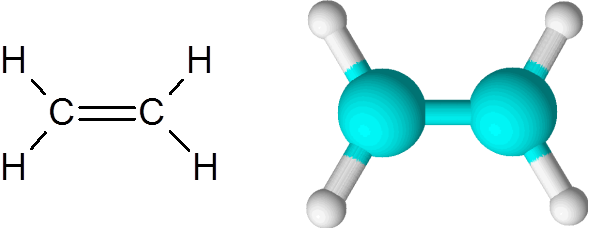 Cząsteczka etylenu
Cząsteczka etylenu Cząsteczka jest całkowicie płaska i nie jest możliwe obrócenie łącza w dowolnym kierunku. To podwójne wiązanie jest całkowicie apolarne, ponieważ łączy dwa równe atomy.
Link c = o w acetonie
Wszystkie ketony zawierają grupę karbonylową, która składa się z atomu węgla i atomu tlenu zjednoczonych za pomocą podwójnego wiązania kowalencyjnego.
Może ci służyć: jaka jest kinetyka chemiczna?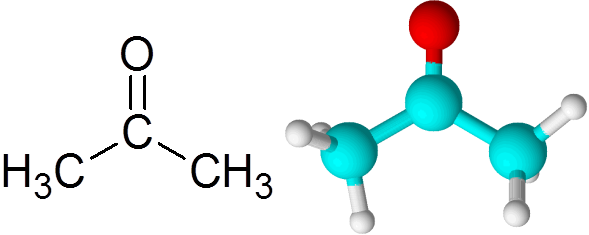 Cząsteczka acetonowa
Cząsteczka acetonowa Każdy atom przyczynia się do dwóch brakujących elektronów, tworząc zarówno łącze PI, jak i sigma, które tworzą podwójne wiązanie. Większość reakcji chemicznych występujących na ketony jest spowodowana podwójnym wiązaniem C = O.
Link o = lub w cząsteczce ozonu (lub3)
W tym przypadku środkowy atom tlenu jest powiązany z dwoma innymi atomami tlenu. Jedno z dwóch wiązań jest tworzone przez 4 elektrony, więc odpowiada podwójnej kowalencyjnej wiązaniu. Trzy atomy i kilka elektronów bez dzielenia się, które mają środkowy atom tlenu, znajdują się w tej samej płaszczyźnie ekranu, wskazując na narożniki trójkąta.
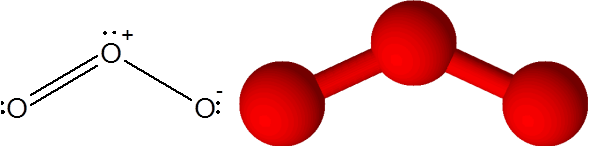 Cząsteczka ozonu
Cząsteczka ozonu Ozon ma osobliwość, że podwójne wiązanie może „przeskakiwać” z jednego z końcowego tlenu do drugiego. W rzeczywistości robi to bardzo szybko poprzez proces zwany rezonansem.
C = C linki w Butadieno (C4H6)
Butadieno jest przykładem związku organicznego, który ma dwa podwójne wiązania kowalencyjne C = C.
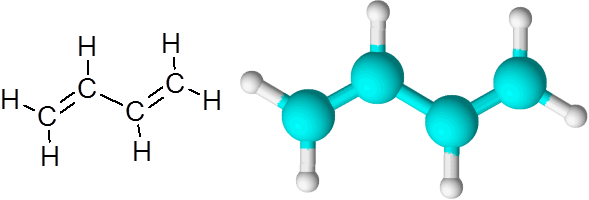 1.3-butadiene cząsteczka
1.3-butadiene cząsteczka Kiedy podwójne wiązania są w ten sposób, oddzielone jednym prostym łączem, mówi się, że są to sprzężone podwójne linki.

