Energia wewnętrzna

- 2594
- 588
- Gabriela Łuczak
Wyjaśniamy, czym jest energia wewnętrzna, jej funkcja, jak ją obliczyć i podajemy kilka przykładów
 Diagram pokazujący wkład w energię wewnętrzną systemu. Źródło: f. Zapata
Diagram pokazujący wkład w energię wewnętrzną systemu. Źródło: f. Zapata Co to jest energia wewnętrzna?
energia wewnętrzna Z obiektu wynika z losowego ruchu, jaki mają atomy i cząsteczki. Nawet gdy obiekt jest idealnie spoczynkowy, wewnątrz, na poziomie mikroskopowym, cząstki, które tworzą go porusza się w sposób ciągły bez odpoczynku.
Ponieważ te cząstki się poruszają, mają energię kinetyczną, która jest częścią ich energii wewnętrznej. Drugim wkładem w energię wewnętrzną jest energia potencjalna, która pochodzi z sił międzycząsteczkowych, odpowiedzialnych za utrzymanie spójności substancji.
Te siły międzycząsteczkowe mają zwykle pochodzenie elektromagnetyczne, ale uczestniczą również siły grawitacyjne i nuklearne.
Teraz, w zależności od rodzaju ruchu cząstek, energia kinetyczna może być:
- Translacja
- Wibracyjny
- Rotacyjny
Temperatura mierzy tylko translacyjną energię kinetyczną cząstek. Zasadniczo w większej temperaturze energia wewnętrzna będzie większa, ale zależy to również od masy. A przykład Problem wyjaśnia: szkło z ciepłą wodą ma mniej energii wewnętrznej niż jezioro w temperaturze pokojowej, chociaż temperatura szkła jest wyższa, a to dlatego, że w jeziorze jest więcej wody niż w szkle.
W każdym razie energia wewnętrzna substancji nie jest zauważalna, nie zależy od jej ruchu, ani nie zależy od jego względnej pozycji w odniesieniu do innych obiektów. Na przykład wewnętrzna energia szkła z wodą w temperaturze pokojowej jest taka sama, jeśli szkło jest na stole lub jeśli znajduje się na podłodze.
Może ci służyć: wektory nieokoplanarne: definicja, warunki, ćwiczeniaWewnętrzna funkcja energii
Energia wewnętrzna, która jest zwykle oznaczona jako U, jest funkcją, która zależy od zmiennych termodynamicznych systemu, takich jak temperatura T i objętość V. Dlatego można to wyrazić matematycznie jako:
U = u (t, v)
W rzeczywistości wartość bezwzględna energii wewnętrznej systemu nie jest istotna, liczy się jej zmienność, która jest oznaczona literą grecką δ („delta”):
Δu = u wstępny - LUB finał
Teraz energia wewnętrzna może być zróżnicowana, jeśli ciepło zostanie dodane lub wyodrębnione. Dodając ciepło Możliwe, że system wykonuje określoną robotę, na przykład tłok w cylindrze silnika.
Pierwsze prawo termodynamiki
Z pierwszego prawa termodynamiki ustalono, że Zmienność energii wewnętrznej Z systemu równoważnego:
Δu = q - w
Gdzie jest ilość ciepła przenoszonego do systemu, a W to praca, którą wykonuje system, na wypadek, gdyby wykonał trochę. Wszystko jest mierzone w dżule w międzynarodowym systemie jednostek.
Jeśli system nie działa, dostarczone ciepło jest używane w całości do zwiększenia energii wewnętrznej systemu.
Poniżej następuje z poprzedniego wyrażenia:
- ΔU> 0 oznacza, że system zwiększa swoją energię wewnętrzną
- Δu < 0 la energía interna del sistema disminuye
- Q> 0 System pochłania ciepło
- W> 0 System działa.
Jak obliczyć energię wewnętrzną?
Monoatomic Ideal Gas
W modelu Monoatomic Ideal Gas (pojedynczy atom) cząstki nie oddziałują ze sobą, tak że translacyjna energia kinetyczna jest jedynym wkładem w energię wewnętrzną lub gazem wewnętrznym. Istnieje twierdzenie o nazwie Twierdzenie o wyposażeniu, który stwierdza, że każdy stopień wolności ma energię równą:
Może ci służyć: dyfrakcja fali: koncepcja i przykładyGdzie T jest temperaturą, a R jest stałą gazów idealnych, których wartość w jednostkach systemu międzynarodowego wynosi:
8.314472 J/mol ∙ k
Stopień swobody stanowi możliwość poruszania się w określonym kierunku w przestrzeni. Idealna cząstka gazu może poruszać się w trzech kierunkach przestrzeni, dlatego energia n moli gazu wynosi:
Ilość ciepła
Zakładając, że ciepło jest dodawane do systemu, a to nie działa, ciepło to jest używane tylko do zwiększania energii wewnętrznej systemu. Ilość ciepła, które musi być proporcjonalne do masy M systemu i zmiany temperatury:
Q ∝ m⋅Δt
Stała proporcjonalności zależy od substancji i jest nazywana ciepło właściwe. Wzywając C do tej stałej, ciepło brzmi:
Q = Mc⋅δT
Ponieważ ciepło jest odwracane w rosnącej energii wewnętrznej:
Q = mc⋅Δt = δu
Δu odpowiada wariacja W energii wewnętrznej.
Przykłady energii wewnętrznej
1. Wariacji temperatury
Zmiany temperatury substancji z kolei generują zmiany ich energii wewnętrznej. Tak się dzieje na przykład podczas gotowania. Przez ogrzewanie pokarmu wzrasta wzrośnie jej cząsteczek, wzrasta energia kinetyczna, a zatem energia wewnętrzna.
2. Energia wewnętrzna dwóch substancji w tej samej temperaturze
Dwie substancje w tej samej temperaturze niekoniecznie mają tę samą energię wewnętrzną, ponieważ zależy to od dwóch wkładów: energii kinetycznej i energii potencjalnej.
Jeśli substancje znajdują się w tej samej temperaturze, można potwierdzić, że translacyjna energia kinetyczna jej cząstek jest taka sama, ale energia potencjalna jest inna, ponieważ zależy to od konfiguracji atomów składowych.
Może ci służyć: ciśnienie hydrostatyczne: wzór, obliczenia, przykłady, ćwiczenia3. Rozszerzalność cieplna
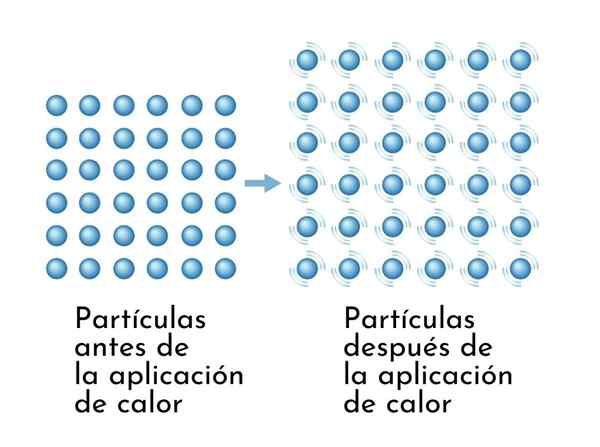 Substancje rozszerzają się po podgrzaniu, ponieważ wzrost energii wewnętrznej powoduje szersze wibrujące cząsteczki, więc wymiary rosną
Substancje rozszerzają się po podgrzaniu, ponieważ wzrost energii wewnętrznej powoduje szersze wibrujące cząsteczki, więc wymiary rosną Widoczną konsekwencją substancji grzewczych jest wzrost ich wymiarów, ponieważ zwiększa się średnia odległość między jej atomami.
Siły międzycząsteczkowe można symulować przez źródła, które łączą atom.
4. Sprężone gazy
Gazy sprężone mogą przechowywać energię wewnętrzną, ponieważ ich gęstość wzrasta poprzez zmniejszenie objętości, a wraz z nią interakcje ze ścianami pojemnika pojemnika. W ten sposób sprężony gaz jest w stanie wykonywać pracę, taką jak poruszenie tłoka.
5. Baterie
W reakcjach chemicznych w akumulatorach zdolnych do generowania prądu elektrycznego, gdy tylko obwód się zamknie. Ta chemiczna energia potencjalna jest uważana za część energii wewnętrznej systemu.
6. System, który pochłania ciepło i działa
Gdy system pochłania ciepło, zwiększa swoją energię wewnętrzną. Ale jeśli jednocześnie wykonuje pracę, można użyć pierwszego prawa termodynamiki, aby wiedzieć, ile zmian energii wewnętrznej. Na przykład, zakładając, że system pochłania 175 J ciepła i wykonuje zadanie równoważne 62 J, zmiana energii wewnętrznej wynosi:
Δu = Q - w = 175 J - 62 J = 113 J.



