Energia aktywacji

- 3413
- 883
- Pani Gilbert Stolarczyk
Wyjaśniamy, jaka jest energia aktywacyjna, jej formuła, jednostki, jak jest obliczana i podajemy kilka przykładów
Co to jest energia aktywacyjna?
Energia aktywacji (IDo) Jest zdefiniowany jako minimalna energia niezbędna do przeprowadzenia reakcji chemicznej. Innymi słowy, jest to bariera energetyczna, którą należy pokonać, aby odczynniki mogły stać się produktami.
Energia aktywacji można zobaczyć w akcji w życiu codziennym. Rzeczywiście, wszyscy wiemy, że otwierając klucz do krawędzi gazu w kuchni, nie płonie natychmiast, gdy wchodzi w kontakt z powietrzem.
Tak że rozpoczęła się reakcja spalania, konieczne jest zapewnienie iskierki lub ognia meczu. Ta iskra lub ten ogień reprezentuje energię aktywacji reakcji spalania.
Dlaczego wymagana jest energia aktywacyjna?
Aby zrozumieć powód, dla którego reakcje potrzebują minimalnej energii, ważne jest, aby zrozumieć, przede wszystkim, jak się one. Aby reagować dwa atomy lub cząsteczki, muszą najpierw zderzyć się. Ponadto muszą to zrobić z właściwą orientacją, aby mogły być tworzone nowe wiązania chemiczne, a starzy ludzie.
Jednak nawet jeśli dwie cząsteczki są skierowane do siebie z doskonałą orientacją, nie zapewnia to, że podano skuteczną kolizję z powodu odpychania między elektronami powierzchni cząsteczek.
Z tego powodu konieczne jest, aby oprócz prawidłowej orientacji cząsteczki przemieszczały się również z pewną prędkością lub z minimalną energią kinetyczną, która zapewnia, że kolizja jest wystarczająco silna, aby przeciwdziałać odpychaniu elektronów.
Ta minimalna energia kinetyczna niezbędna na poziomie mikroskopowym jest ta, która przekłada się na energię aktywacji reakcji.
Może ci służyć: bromek litowy: struktura, właściwości, zastosowania, ryzykoCo widać na schemacie energii?
Schemat energii to reprezentacja graficzna, która pokazuje, jak zmienia się energia odczynników, gdy są one przekształcane w produkty. Na tych schematach, takich jak ten przedstawiony poniżej, łatwo jest zobaczyć i interpretować energię aktywacji.

Na tym wykresie niebieska linia pokazuje energię w miarę postępu reakcji. Tutaj widać, że aby stać się produktami, odczynniki muszą najpierw pokonać wzgórze, aby dotrzeć do stanu przejściowego. W przeciwnym razie zostaną zwrócone do stanu początkowego.
Wysokość tego wzgórza jest precyzyjnie aktywacyjna energia. Jeśli można pokonać, reszta drogi jest zjazdem, a odczynniki szybko stają się produktami.
Jednostki energetyczne aktywacji
Energia aktywacji jest intensywną wielością wyrażoną w jednostkach energetycznych nad masą lub moczą. Ponieważ istnieją różne jednostki energetyczne i różne jednostki masy, energia aktywacji może być wyrażona w kilku różnych jednostkach. Jednak osoby stosowane najczęściej w chemii to:
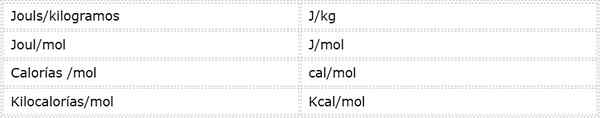
Która jednostka jest używana, zależy od danych, na których jest obliczane, lub użycia, które zostanie podane w innych obliczeniach.
Formuła energii aktywacji
Energia aktywacji jest związana z prędkością reakcji. W rzeczywistości im większa energia aktywacyjna, tym niższa prędkość. Związek ten jest wyrażany matematycznie poprzez równanie Arrheniusa, które wiąże stałą prędkości reakcji na temperaturę.
Może ci służyć: Benedict Reagent: Co to jest, komponenty, przygotowanie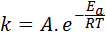
W tym równaniu, k Jest to stała prędkości reakcji iDo Jest to energia aktywacji, R jest stałą gazów idealnych, t jest temperaturą bezwzględną i nazywa się czynnikiem przedefektywnym Arrhenius, zwanym również czynnikiem kolizji.
To równanie można zmienić, aby dać:
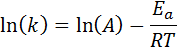
Jeśli wartość A dla reakcji jest znana, energię aktywacyjną można uzyskać przez wyczyszczenie poprzedniego równania. Jednak nie jest to sposób, w jaki zwykle określana jest energia aktywacji reakcji. Zwykle stała prędkości jest określana w dwóch lub więcej temperaturach, co sprawia, że nie jest konieczne.
Jak obliczana jest energia aktywacyjna?
Energia aktywacji jest określana na podstawie wartości stałej prędkości w różnych temperaturach. Co najmniej dwie wartości k mierzone przy różnych wartościach t w celu obliczenia energii aktywacji bez wiedzy, co zwykle tak jest.
W zależności od liczby wartości k Mają, możesz obliczyć iDo Na dwa sposoby:
1. Kiedy masz k w dwóch temperaturach
W takich przypadkach łatwiej jest zacząć od pierwszej formy równania Arrheniusa. Jeśli zadzwonimy k1 do stałej prędkości w temperaturze T1 I k2 do stałej prędkości w temperaturze T2, Następnie możemy dwukrotnie napisać równanie Arrheniusa:
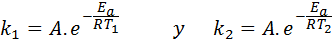
Teraz możemy podzielić dowolne z dwóch równań między drugim, aby anulować:
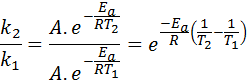
Następnie, biorąc neperiański logarytm po obu stronach i rozwiązywanie rozwiązania dla EDo, otrzymuje:
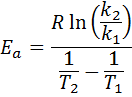
2. Kiedy masz k więcej niż dwie temperatury
W przypadkach, w których istnieje kilka ustaleń stałej prędkości w różnych temperaturach, lepiej jest znaleźć energię aktywacyjną graficznie lub za pomocą regresji liniowej. Opiera się to na równaniu w formie logarytmicznej, która ma kształt linii:
Może ci służyć: równanie Clausius-clapeyron: po co to jest przykłady, ćwiczenia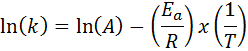
Jeśli wykonamy wykres LN (k) w porównaniu z (1/t), otrzymamy linię prostą, która przecina osi I w ln (a) i którego nachylenie jest równe -(eDo/R). Stamtąd uzyskuje się energię aktywacyjną.
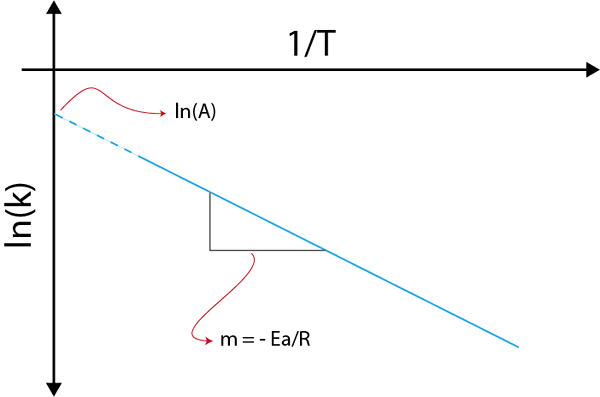 Wykres arrhenius w celu określenia energii aktywacji
Wykres arrhenius w celu określenia energii aktywacji Przykłady obliczania energii aktywacji
Przykład 1
Stałą prędkości reakcji pierwszego rzędu określono w dwóch różnych temperaturach. 298 K miał wartość 0.058 s-1, podczas 350 K wartość wzrosła do 0,425 s-1. Określ energię aktywacji tej reakcji w J/mol.
- Rozwiązanie: Ponieważ masz stałą w dwóch temperaturach, przedstawiony powyżej wzór energii aktywacji można użyć bezpośrednio. Ponieważ energia jest wymagana w jednostkach J/Mol, musimy użyć stałej gazu w tych jednostkach:
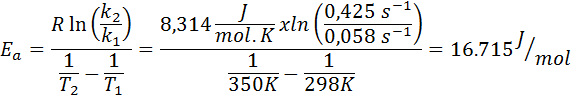
Przykład 2
Stała prędkości dla drugiego rzędu reakcja chemiczna jest mierzona w różnych temperaturach. Wartości przedstawiono w poniższej tabeli. Określ energię aktywacyjną w KCAL/mol.
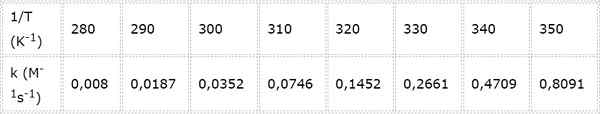
- Rozwiązanie: Ponieważ w tym przypadku istnieje kilka temperatur, preferowane jest określenie energii aktywacyjnej graficznie. Aby to zrobić, wykonany jest wykres LN (k) vs 1/t, który przedstawiono poniżej.
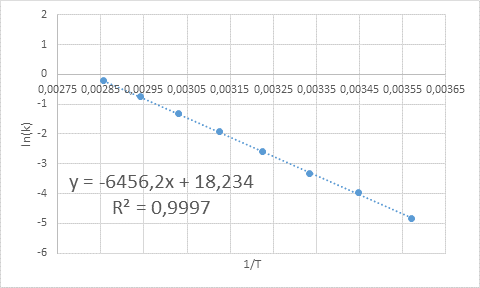 Przykład graficznego określenia energii aktywacji
Przykład graficznego określenia energii aktywacji Z równania linii pokazanej na wykresie uzyskuje się nachylenie, czyli -6456.2. Ponieważ nachylenie (m) jest równe - eDo/R, zatem:
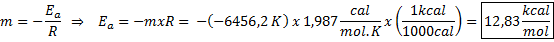
Oznacza to, że energia aktywacji tej reakcji wynosi 12,83 kcal/mol.

