Elektrony wewnętrzne

- 2254
- 621
- Herbert Wróblewski
Wyjaśniamy, jakie są wewnętrzne elektrony, ich cechy i podajemy kilka przykładów
Co to są wewnętrzne elektrony?
Ilekroć myślimy o atomie, wyobrażamy sobie jądro utworzone przez protony i neutrony, otoczone elektronami, które obracają się wokół niego, podobnie jak planety obracają się wokół słońca.
Ale nie wszystkie elektrony są takie same, a dwie klasy można rozróżnić, w zależności od tego, jak blisko lub daleko są od jądra atomowego.
Niektóre są dalej od jądra i nazywane są elektronami Valencia. Są one odpowiedzialne za wszystkie reakcje chemiczne, które znamy. Z drugiej strony, Ci, którzy są najbliżej jądra i są z nim silniej zjednoczeni, to te, które nazywamy elektronami wewnętrznymi.
Charakterystyka elektronów wewnętrznych
Są to najbardziej stabilne elektrony
Zasadniczo, im niższy poziom energii elektronu, jest to bardziej stabilne. Elektrony wewnętrzne zajmują orbitale na najniższych poziomach energii atomu, dlatego są to również najbardziej stabilne elektrony.
Są silniej zjednoczeni z jądrem
Jądro przyciąga elektrony, ponieważ oba mają przeciwne obciążenia: jądro jest dodatnie, podczas gdy elektrony ujemne. Siła ta rośnie wraz ze spadkiem odległości.
W wyniku tego wewnętrzne elektrony, które są najbliżej jądra, są również tymi, które są najsilniej powiązane z tym samym. Z tego samego powodu są również najtrudniejszymi elektronami do usunięcia.
Nie są częścią wiązań chemicznych
Kiedy jeden atom zbliża się do drugiego, pierwszą rzeczą do dotknięcia jest ich najbardziej zewnętrzne elektrony. Z tego powodu tylko elektrony Valencia interweniują w reakcje chemiczne. Elektrony wewnętrzne ani nie uczestniczą w wiązaniach chemicznych, ani nie są zaangażowane w żadną reakcję chemiczną.
Może ci służyć: ile ma elektronów kremowych?Są bardzo ekranowe
Oznacza to, że wewnętrzne elektrony stoją między elektronami zewnętrznymi a jądrem, tworząc rodzaj ekranu, który zmniejsza siłę, z jaką jądro przyciąga elektrony wartościowości.
Zawsze przychodzą parami
Na każdym orbicie znajdują się tylko dwa elektrony z przeciwnymi spinami, które nazywane są sparowanymi elektronami (co jest innym sposobem powiedzenia, że tworzą parę). Podobnie jak orbitale, w których znajdują się wewnętrzne elektrony, są zawsze całkowicie pełne, więc elektrony te są zawsze sparowane.
Skąd wiemy, ile ma wewnętrznych elektronów?
Wiedza, ile elektronów wewnętrznych ma atom, jest bardzo proste. Musisz tylko wiedzieć, ile elektronów ma atom i ile z tych elektronów należy do warstwy Valencia. Wszystkie pozostałe elektrony są elektronami wewnętrznymi.
Ale jak znaleźć te liczby? W poniższych sekcjach wyjaśniamy to.
Całkowita liczba elektronów jest równa liczbie atomowej
Ponieważ atomy są neutralne (to znaczy nie mają ładunku elektrycznego netto), muszą mieć taką samą liczbę dodatnich obciążeń (protonów) jak obciążenia ujemne (elektrony). Jak liczba atomowa wskazuje, ile protonów znajduje się w jądrze, więc wskazuje również, ile elektronów jest w pobliżu, gdy jest neutralny.
W przypadku jonów, które w przeciwieństwie do atomów mają ładunek elektryczny, całkowitą liczbę elektronów uzyskuje się przez odjęcie liczby atomowej z wyjątkiem obciążenia jonowego, ze wszystkim i ich znakiem.
Przykłady
- Atom węgla (C) jest elementem numer 6 tabeli okresowej (czyli jego liczby atomowej). Dlatego atom węgla ma łącznie 6 elektronów.
- Jon sodu (i) (na+) ma dodatni ładunek +1, a liczba atomowa sodu wynosi 11. Tak więc całkowita liczba elektronów tego jonu wynosi: 11 - (+1) = 10 elektronów.
- Jon chlorkowy (CL-) ma ujemne obciążenie -1, a liczba atomowa chloru wynosi 17. Tak więc całkowita liczba elektronów tego jonu wynosi: 17 - ( - 1) = 17 + 1 = 18 elektronów.
Liczba elektronów Walencji jest równa ich grupie w stole okresowym
Elementy należące do grupy 1A (metale alkaliczne) mają 1 elektron walencji. Osoby należące do drugiego (alkalainer) mają 2, te z 3. (Boro Group, Aluminium, Galum itp.) Mają 3 i tak dalej. Nie dotyczy to metali przejściowych.
Podobnie jak poprzednio, jony odejmowane są od obliczania ich walencji elektronów.
Przykłady
- Tlen należy do grupy 6A dla 6 elektronów walencyjnych.
- Jon siarczkowy (s2-) Należy również do grupy 6A, ale ma obciążenie -2, więc ma: 6 -( -2) = 6 + 2 = 8 elektronów Valencia.
Przykłady różnych atomów i ich wewnętrznych elektronów
Wewnętrzne elektrony węglowe (c)

Jak widzieliśmy chwilę temu, węgiel ma w sumie 6 elektronów. Ponadto należy do grupy 4A dla 4 elektronów walencji, więc ma łącznie 6 - 4 = 2 wewnętrzne elektrony.
Wewnętrzne elektrony azotu (N)
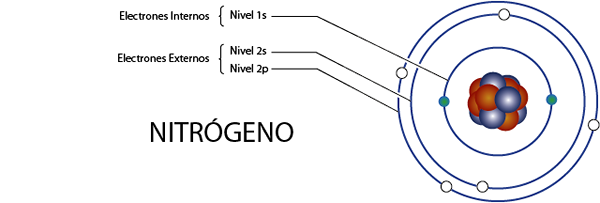
Azot ma łącznie 7 elektronów. Ponadto należy do grupy 5A dla 5 elektronów walencji, więc ma łącznie 7 - 5 = 2 wewnętrzne elektrony.
Elektrony wewnętrzne Argonu (AR)
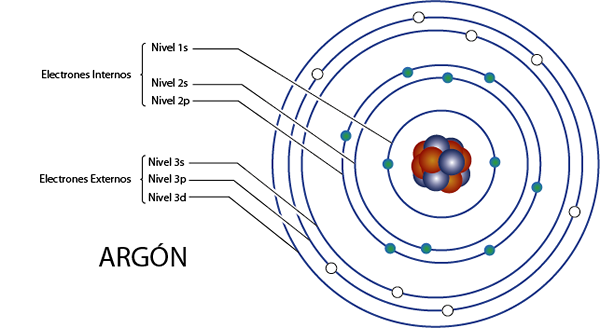
Argon jest elementem 18 za to, co ma 18 elektronów. Ponadto należy do grupy 8A dla 8 elektronów walencji, więc ma łącznie 18 - 8 = 10 elektronów wewnętrznych.
Elektrony wewnętrzne jonu chlorkowego (Cl-)
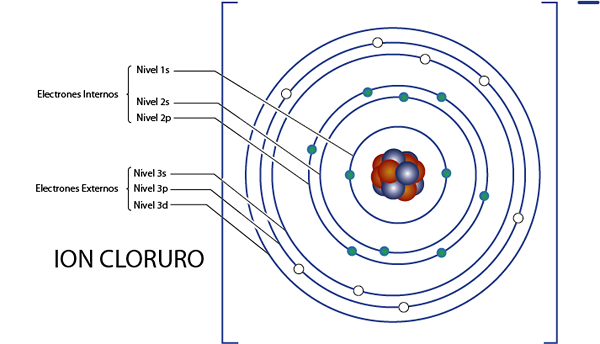
Jak widzieliśmy chwilę temu, chlorek ma łącznie 18 elektronów. Ponadto należy do grupy 7A i ma obciążenie -1, więc ma 7 - ( - 1) = 8 elektronów Valencia. Więc ma 18 - 8 = 10 elektronów wewnętrznych, Jak argon.
Może ci służyć: chemia nuklearna: historia, dziedzina studiów, obszary, zastosowaniaElektrony wewnętrzne jonu wapnia +2 (CA2+)
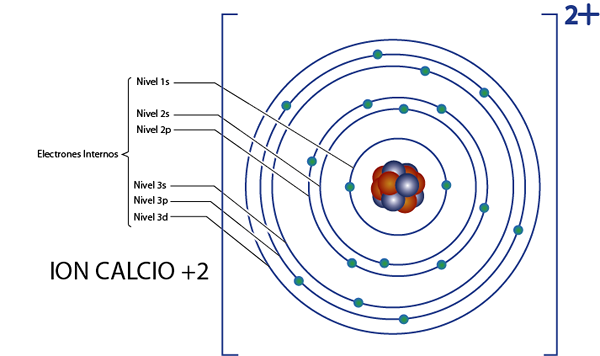
Wapń ma element 20, a jon ten ma 2 dodatnie ładunki, więc ma w sumie 20 - 2 = 18 elektronów wokół jądra. Ten element należy do grupy 2a, a ponieważ jego obciążenie wynosi +2, wówczas nie ma elektronów walencyjnych (2 - 2 = 0). Z tego powodu wszystkie 18 elektronów pozostawionych przez wapń to te, które pierwotnie były wewnętrznymi elektronami.
Istnieją dwa elementy, które nie mają wewnętrznych elektronów
Dwa lżejsze elementy stolika okresowego, które są wodorem (H) i helem (He), mają tylko 1 i 2 elektrony. Oba elektrony mają jedyny poziom energii, jaki mają te atomy, czyli poziom 1.
Z tego powodu elektrony te odpowiadają elektronom walencyjnym tych dwóch elementów. Ponieważ nie ma niższych poziomów energii, nie ma również wewnętrznych elektronów.

