Charakterystyka elektrody odniesienia, funkcja, przykłady
- 4402
- 1248
- Marianna Czarnecki
On Elektroda odniesienia Jest to urządzenie używane w analizie potencjometrycznej i woltamérrycznej do ilościowego oznaczania analitu. Jego znaczenie jest, jak sama nazwa wskazuje, służyć jako odniesienie do oszacowania prawdziwej wartości potencjału w reakcji elektrochemicznej półelki.
Potencjał półproduktu zależą od stężenia jonu w interesującym. W ten sposób możliwe jest określenie ich koncentracji poprzez te potencjały. Jednak ich wartości nie są bezwzględne, ale związane ze standardową elektrodą wodoru (ona po angielsku).
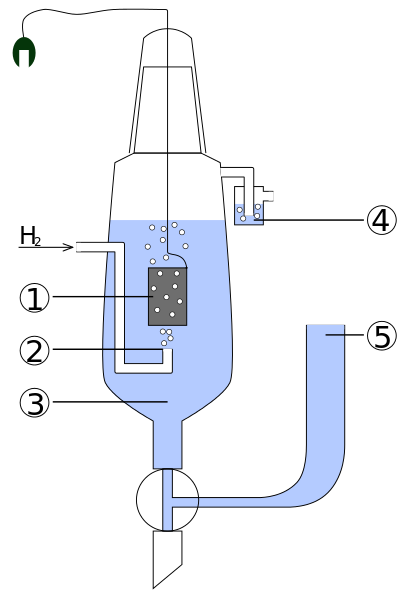
 Schemat części standardowego elektro wodoru. Źródło: standard_hydrogen_electrode.JPG: Kaverinderivevative Praca: Henry Muelpfordt/CC By-S (http: // creativeCommons.Org/licencje/by-sa/3.0/)
Schemat części standardowego elektro wodoru. Źródło: standard_hydrogen_electrode.JPG: Kaverinderivevative Praca: Henry Muelpfordt/CC By-S (http: // creativeCommons.Org/licencje/by-sa/3.0/) Według konwencji potencjały elektrody wodorowej są równe 0 V. Problem polega na tym, że elektrody te są trudne do manipulowania, więc nie są one praktyczne do zainstalowania ich we wszystkich analizach. W tym miejscu wchodzą elektrody referencyjne, znacznie prostsze i których potencjał różni się od 0 V.
Niektóre elektrody odniesienia, takie jak nasycona elektroda Calomel (ESC), można zbudować w tym samym laboratorium przed przeprowadzeniem analizy. Podobnie, są one otwarcie uzyskiwane na rynku z odpowiednimi specyfikacjami, a ryzyko zanieczyszczenia próbki analitu jest minimalne.
[TOC]
Charakterystyka elektrody odniesienia
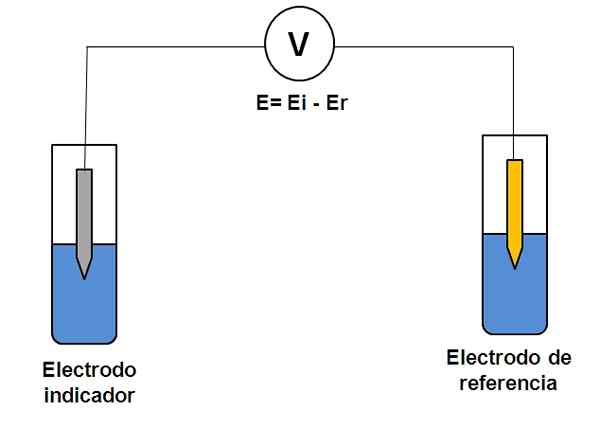 Prosta reprezentacja systemu dwóch elektrod w potencjometrii. Źródło: Gabriel Bolívar.
Prosta reprezentacja systemu dwóch elektrod w potencjometrii. Źródło: Gabriel Bolívar. Rozważ powyższe dwa system elektrod. Jednym z nich jest wskaźnik (szary), w którym zachodzi reakcja zainteresowania, a druga to odniesienie (złoto). Ta komórka elektrochemii będzie miała potencjał i, która będzie równa różnicy potencjałów obu elektrod (EI-E). Dlatego każda zmienność E musi wynikać z potencjału elektrody wskaźnika.
Może ci służyć: cyjanku potasu (KCN): właściwości, zastosowania, struktury, ryzyko,Z powyższego stwierdzono, że elektroda odniesienia ma następujące cechy:
-Ma stabilny potencjał w czasie i jest powtarzalny. Oznacza to, że powinno być takie samo niezależnie od tego, gdzie lub ile razy dokonywane są pomiary.
-Jego skład chemiczny jest stały i niewrażliwy, więc prawie nie ulega zmianom, gdy oddziałuje on z roztworem analitu lub zanurza się w wodnym pożywce.
-Łatwo jest zbudować i zamontować, w przeciwieństwie do standardowej elektrody wodorowej, która wymaga zastosowania zbiornika wodoru i prowadzi ryzyko eksplozji, gdy wodór miesza się z powietrzem z powietrzem z powietrzem.
Elektroda wskaźnikowa jest wrażliwa na stężenie analitu.
Funkcja elektrody odniesienia
Potencjały elektrod odniesienia są mierzone w stosunku do standardowej elektrody wodorowej, więc ich wartości różnią się od 0 V. Dzięki tym elektrodom wodorowym możliwa jest budowa standardowych i standardowych tabel potencjalnych, które pojawiają się w tekstach chemii dla symfin reakcji redoks.
Jednak w praktyce nie ładuje elektrody wodorowej wszędzie. Zamiast tego używane są elektrody odniesienia, znacznie prostsze i bezpieczne do manipulowania.
Ponieważ jego potencjały są stałe i stabilne, potencjalne odczyty komórki elektrochemii są wyłącznie spowodowane elektrodą wskaźnikową; to znaczy, do zmian stężenia danego analitu.
Zatem funkcja elektrody odniesienia polega na określeniu potencjału dowolnej reakcji w jednym z pół -limitów układu elektrochemicznego. Gdyby ich potencjały nie były stabilne, ilościowe ustalenia analitu nie byłyby wiarygodne. Każda analiza potencjometryczna lub woltametryczna powinna określić, która elektroda odniesienia użyła do zgłoszenia swoich wyników.
Może ci służyć: kwas bromowy (HBRO2): właściwości fizyczne i chemiczne oraz zastosowaniaPrzykłady elektrod referencyjnych
Na rynku znajduje się kilka dostępnych elektrod referencyjnych. Niektóre używane do bardzo specyficznych ustaleń. Istnieją jednak dwie elektrody wśród tych wszystkich, które wyróżniają się dzięki ich prostocie i praktyczności: elektrodę kalomelową i srebrnym srebrze, oba bardzo powtarzające się w wielu analizach potencjometrycznych i woltamletrycznych.
Elektroda Calomel
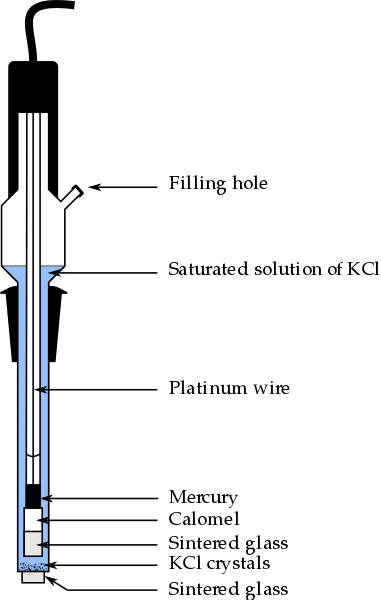 Części elektrody kalomelowej, jedna z najczęściej używanych elektrod odniesienia w chemii analitycznej. Źródło: Bachi-Bouzouk przez Wikipedia.
Części elektrody kalomelowej, jedna z najczęściej używanych elektrod odniesienia w chemii analitycznej. Źródło: Bachi-Bouzouk przez Wikipedia. Na górnym obrazie pokazano konwencjonalne części nasyconej elektrody kalomelowej, ECS. Mówi się, że jest nasycony, ponieważ zawiera nasycone roztwór KCl (niebieski), który również przedstawia ujaśnienia KCl.
Kolumna wewnętrzna, przejechana przez drut platynowy, jest wypełniony rtęcią, która z kolei kontaktuje się z pastą kalomelową, HG2Cl2 o Merkury chlorek (I) i nasycony roztwór KCl. Zatem w tej elektrodzie stężenie jonów CL jest ważne-, Ponieważ jego wartość modyfikuje potencjał elektrody.
Reakcja, która zachodzi, jest następująca:
Hg2Cl2(s) + 2e- ⇌ 2Hg (l) + 2cl-
I ma eº 0.241 v.
Na dolnym końcu ECS znajduje się porowato smażony, który jest w kontakcie elektrycznym z rozwiązaniem analitu i umożliwia kontrolowaną wymianę jonów jonów-. W przeciwnym razie w próbce nastąpiło zanieczyszczenie chlorków, a także elektroda straciłaby swoją cenną nasyconą roztwór KCL.
Ta elektroda jest używana do pomiarów pH i ogólnie z dowolnego analitu, którego stężenie można określić w środowisku wodnym.
Może ci podawać: alkohol termiczny: struktura, właściwości, ryzyko i zastosowaniaSrebrna elektroda srebrna
 Srebrny electro. Źródło: TenofallTrades (dyskusja) (przesyłania). / Domena publiczna
Srebrny electro. Źródło: TenofallTrades (dyskusja) (przesyłania). / Domena publiczna Podobnie jak elektroda Calomela, srebrna elektroda składa się ze srebrnego drutu pokrytego srebrnym chlorkiem, a także zanurzonym w roztworze nasyconym mieszaniną KCl i AGCL.
Wszystkie jej części są chronione w plastikowej rurce, która ma porowaty otwór, przez który ustanawia kontakt elektryczny z roztworem.
Reakcja, która określa jego potencjał, eº = 0.197 V, jest następujący:
AGCL (s) + e- ⇌ Ag (S)+Cl-
Ta elektroda przedstawia większe zastosowania i preferencje niż kalomel, co jest spowodowane negatywnym wpływem rtęci na środowisko. Z drugiej strony srebrne srebrne elektrody są prostsze, bezpieczne i tanie w budowie w laboratorium.
Mówimy zatem, że elektroda srebrnego zastępuje Calomel w wielu swoich zastosowaniach (stopnie potencjometryczne, testy korozji, analiza elektrochemiczna itp.).
Jest to również jedna z preferowanych opcji biologii i medycyny, szczególnie w elektrokardiografii i elektroencefalografii, ponieważ srebro lub ich sól są stosunkowo toksycznymi substancjami dla ciała.
Bibliografia
- Dzień, r., & Underwood, a. (1965). Ilościowa chemia analityczna. (Ed.). Pearson Prentice Hall.
- Skoog d.DO., West d.M. (1986). Analiza instrumentalna. (Drugi wyd.). Inter -American., Meksyk.
- Wikipedia. (2020). Odniesienie do elektrody. Źródło: w:.Wikipedia.org
- Elsevier b.V. (2020). Odniesienie do elektrody. Scientedirect. Pobrano z: Scientedirect.com
- Chemia librettexts. (9 czerwca 2020). Elektrody referencyjne. Odzyskane z: chem.Librettexts.org
- « Lokalizacja latarni morskiej Aleksandrii, historia, opis, ruiny
- Emily Dickinson Biografia, osiągnięcia, prace, frazy »

