Elektrodializy, jak działa, zalety, wady, używa
- 4609
- 493
- Maksymilian Kępa
Elektrodializa Jest to ruch jonowy przez półprzepuszczalną membranę, napędzaną różnicą potencjału elektrycznego. Membrany stosowane w elektrodializy mają właściwość bycia wymiennikami jonów dla kationów lub anionów.
Membrany wymiany kationów mają ujemne obciążenia: pozwalają kationom przejść i odpychają aniony. Tymczasem membrany wymiany anionowej mają opłatę dodatnią: pozwalają anionom i odpychaniu kationów.
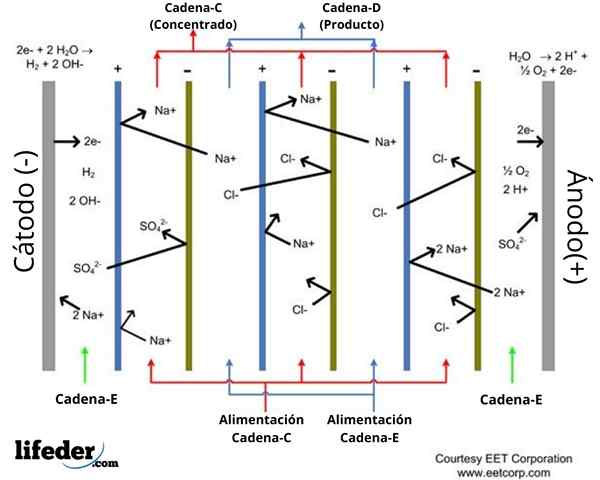
 Schemat pakietu pięciu ogniw elektrodializy. Źródło: Commonshelper2 przez Wikipedia.
Schemat pakietu pięciu ogniw elektrodializy. Źródło: Commonshelper2 przez Wikipedia. Kamery lub komórki elektrodializy są zorganizowane w opakowaniach z kilkoma błonami wymiany anionowych i kationowych, które na przemian ze sobą. Anionowe i kationowe błony wymiany wyznaczają przestrzenie, w których przeprowadzane są procesy rozcieńczenia i stężenia cieczy.
Siła napędowa przepływów jonowych, które przekraczają błony ogniw elektrodializy, jest różnicą potencjału elektrycznego między katodą a anodą.
Tymczasem w odwróconej osmozie przepływ wody z przedziału z największą osmolarnością do dolnej przedziału osmolarnego wynika ze wzrostu ciśnienia hydrostatycznego, spowodowanego działaniem pompy.
[TOC]
Jak działa w rozcieńczeniu wody?
Opis pakietu pięciu ogniw elektrodializy
W pokazanym schemacie (obraz wyższy) wskazano lokalizację sześciu membran wymiany jonowej: trzy wymiany kationów i trzy anionowe wymiany, które są ze sobą przeplatane. Te membrany ograniczają pięć przedziałów, w których krążą ciecze zaangażowane w elektrodializę (patrz czerwone i niebieskawe strzałki).
Anionowe błony wymiany są dodatnio załadowane, pojawiające się w schemacie koloru niebieskiego. Pozwalają one aniony przejść i odpychają kationy na odpychanie elektrostatyczne.
Membrany wymiany kationów, podczas gdy mają obciążenie ujemne, wskazując na zielony schemat. Są one skrzyżowane kationami, jednak odpycha aniony.
Może ci służyć: test: cechy, typy, przykłady zastosowańOba rodzaje membran są wodoodporne do wody. Schemat pokazuje dwie przestrzenie, w których występuje rozcieńczenie zawartości soli fizjologicznej w wodach. W schemacie wodne przepływy wejścia i wyjścia tych przestrzeni są wskazane na niebiesko, zidentyfikowane jako prąd d.
Tymczasem istnieją trzy przestrzenie, w których woda krąży o wysokiej zawartości soli fizjologicznej, identyfikowana na czerwono. Dochody i wyjście przepływy do tych przedziałów są wskazane w programie jako aktualne.
Podobnie przedziały anody (+) i katody (-) są wskazane w schemacie, przez które prąd i.
Operacja elektrodializy
Kationom przyciąga obciążenie katody (-), podczas gdy odpychają anodę (+). Aniony przyciągają obciążenie anody (+) i odpychane przez obciążenie katody (-).
Obserwacja, na przykład, komórek trzecich, czterech i pięciu, wskazuje na następujące: w komórkach trzy i pięć krążących stężonych cieczy, podczas gdy w czterech krążeniach komórkowych krąży.
Jon cl- czterech przedziałów jest przyciągany do obciążenia anody i przekracza membranę wymiany anionowej, która oddziela ją od przedziału piątej.
Tymczasem na jon na+ z przedziału pięć jest odpychane przez dodatnie obciążenie anody, ale nie jest w stanie wprowadzić przedziału cztery. Wynika to z faktu, że membrana, która oddziela przedziały cztery i pięć, ma wymianę anionową, więc odpycha kationów.
Z drugiej strony Na+ czterech przedziałów jest odpychane przez anodę (+) i przekracza błonę wymiany kationowej (-), która oddziela ją od przedziału trzy.
Podsumowując: stężenie Na+ i Cl- Czterech przedziałów ma tendencję do zmniejszania się. Następnie stężenie soli fizjologicznej zmniejsza przedziały rozcieńczenia i zwiększa przedziały stężenia.
Może ci służyć: chemia stosowana: obiekt studiów, gałęzie, znaczenie, przykładyZalety i wady
Zalety
-Elektrodializa jest prosta i ciągłe.
-Leczenie chemiczne nie jest wymagane do regeneracji błon wymiany.
-Istnieje niski koszt eksploatacji i konserwacji, co wymaga niewielkiego miejsca na jego działanie.
Niedogodności
-Cząstki o średnicy większej niż 1 µm mogą utrudniać błony wymiany jonów.
-Nie zaleca się stosowania wody o twardości większej niż 1, ponieważ węglan wapnia tworzy skorupę w komórkach koncentrowanych.
-Wymaga obróbki eliminacji dwutlenku węgla (CO2), ponieważ podczas dysocjacji może modyfikować przewodność wody.
Różnica między dializą a elektrodializyą
Dializa to przepływ wody przez półprzepuszczalną błonę mniejszego przedziału osmolarnego do większego przedziału osmolarnego. Przedział o mniejszej osmolarności ma większe stężenie cząsteczek wody.
Z tego powodu woda płynie na korzyść gradientu stężenia, przedziału z mniejszą osmolarnością do przedziału z większą osmolarnością.
Z drugiej strony elektrodializy jest przepływem jonów przez błonę wymiany jonowej, która pozwala na jony, w zależności od ładunku elektrycznego. Siła napędowa ruchu jonowego jest różnicą potencjału elektrycznego.
W przeciwieństwie do dializy, w elektrodializy nie ma przepływu wody przez błony.
Zastosowania elektrodializy
Demineralizacja wody
Istnieją rośliny elektrodializy, które przetwarzają wodę z wysokimi solami w celu wytworzenia wody pitnej. Elektrodializa jest również wykorzystywana do przetwarzania ścieków z użycia krajowego i przemysłowego, w celu uczynienia ich odpowiednim do późniejszego zużycia.
Może ci służyć: Erlenmeyer Folask: Charakterystyka, zastosowania, metody użytkowaniaW szczególności elektrodializa jest stosowana w odzyskiwaniu cennych metali obecnych w wód ścieków w branżach. Jest również stosowany w usuwaniu soli i roztworów kwasowych oraz w oddzieleniu związków jonowych cząsteczek obojętnych.
Przemysł spożywczy
Chociaż elektrodializa jest stosowana w branży farmaceutycznej, w kosmetykach, a także w innych branżach, najbardziej rozpowszechnione zastosowanie jest w przemyśle spożywczym. Spośród dowolnej aplikacji możemy wspomnieć o:
-Smineralizacja surowicy i melasy
-Stabilizacja kwasu tartarowego wina
-Zmniejszenie kwasowości soków owocowych
-Produkcja białka warzywnego izolowanego
-Niepowodzenie białek surowicy
-Demineralizacja olejków soi i rybnych
-Eliminacja jonów alkalicznych buraków i melasy trzcinowej
-Oczyszczanie odpadów owoców morza
-Demineralizacja winogronu i soku ziemniaczanego
-Stężenie i odzyskiwanie kwasów organicznych
-Produkcja białka sojowego
-Wzbogacanie przeciwutleniające
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2020). Elektrodializa. Źródło: w:.Wikipedia.org
- Lentech b.V. (2020). Co to jest EDI? Odzyskane z: lentech.com
- Mondor m., Ippersiel d., Lamarche f. (2012) Elektrodializy w przetwarzaniu żywności. W: Boye J., Arcand i. (red.) Zielone technologie w produkcji i przetwarzaniu żywności. Seria inżynierii żywności. Springer, Boston, MA. doi.Org/10.1007/978-1-4614-1587-9_12
- Akhter M, Habib G, Qamar His (2018) Zastosowanie elektrodozycji w oczyszczaniu ścieków i wpływ zanieczyszczenia na wydajność procesu. J MEMB SCI Technol 8: 182. Doi: 10.4172/2155-9589.1000182
- H. Strathmann. (6 grudnia 2006). Elektrodiaza i jej zastosowanie w branży procesów chemicznych. Taylor & Francis Online. doi.Org/10.1080/03602548508068411
- « Charakterystyka i przykłady trzeciej osoby
- 8 przykładów najbardziej odpowiednich zasobów graficznych »

