Różnicowy elektron

- 2590
- 218
- Pani Gilbert Stolarczyk
On Różnicowy elektron O wyróżnik jest ostatnim elektronem umieszczonym w sekwencji konfiguracji elektronicznej atomu. Jak masz na imię? Aby odpowiedzieć na to pytanie, konieczne jest znanie podstawowej struktury atomu: jej jądro, pustka i elektrony.
Jądro jest gęstym i zwartym agregatem cząstek dodatnich zwanych protonami, a cząstki neutralne zwane neutronami. Protony definiują liczbę atomową Z i, wraz z neutronami, tworzą masę atomową. Atom nie może jednak nosić tylko pozytywnych ładunków; Dlatego elektrony orbitują wokół jądra, aby go zneutralizować.
 Podstawowa struktura atomu: główne cząstki subatomowe
Podstawowa struktura atomu: główne cząstki subatomowe Zatem dla każdego protonu, który dodaje do jądra, nowy elektron jest włączony do jego orbitali, aby przeciwdziałać rosnącemu ładunku dodatnim. W ten sposób nowy dodany elektron, zróżnicowany elektron, jest ściśle związany z liczbą atomową Z.
Różnicowy elektron znajduje się w najbardziej zewnętrznej warstwie elektronicznej: warstwa Walencji. Dlatego im dalej jądro, tym większa związana energia z nim. Energia ta jest odpowiedzialna za jej udział, a także energię reszty elektronów Valencia, w reakcjach chemicznych charakterystycznych dla pierwiastków.
[TOC]
Liczby kwantowe
Podobnie jak reszta elektronów, elektron różnicowy można zidentyfikować za pomocą czterech liczb kwantowych. Ale jakie są liczby kwantowe? Są to „N”, „L”, „M” i „S”.
Liczba kwantowa „N” oznacza wielkość poziomów atomu i energii (K, L, M, N, OR, P, Q). „L” jest wtórną lub odchodową liczbą kwantową, która wskazuje kształt orbitali atomowych i przyjmuje wartości 0, 1, 2 i 3 dla orbitali „S”, „P”, „D” i „F” „odpowiednio.
Może ci służyć: Aforatowana kolba: Charakterystyka, do czego jest typów, używa„M” jest magnetyczną liczbą kwantową i wskazuje przestrzenną orientację orbitali pod polem magnetycznym. Zatem 0 dla orbity „s”; -1, 0, +1, dla orbity „p”; -2, -1, 0, +1, +2, dla orbity „d”; i -3, -2, -1, 0, +1, +2, +3, dla orbity „f”. Wreszcie liczba kwantowa Spin „S” (+1/2 dla ↑ i -1/2 dla ↓).
Dlatego elektron różnicowy powiązał poprzednie liczby kwantowe („N”, „L”, „M”, „S”). Ponieważ przeciwdziała nowemu dodatnim obciążeniu generowanym przez dodatkowy proton, zapewnia również liczbę atomową Z elementu.
Jak poznać elektron różnicowy?
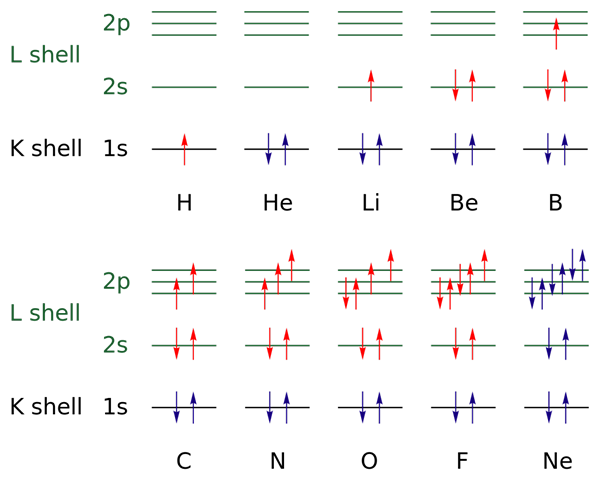
Na górnym obrazie konfiguracje elektroniczne są reprezentowane dla pierwiastków od wodoru do gazu neonowego (H → NE).
W tym elektrony otwartych warstw są wskazane kolorowo czerwonymi, podczas gdy elektryki zamkniętych warstw są wskazane kolorowym niebieskim. Warstwy odnoszą się do liczby kwantowej „n”, pierwszego z czterech.
W ten sposób konfiguracja H (↑ czerwonych) Valencicia dodaje kolejny elektron z przeciwną orientacją, aby stać się konfiguracją HE (↓ ↑, oba niebieskie, ponieważ teraz poziom 1 jest zamknięty). Ten dodany elektron jest wówczas elektronem różnicowym.
W ten sposób można zaobserwować, w jaki sposób elektron różnicowy dodaje do warstwy walencyjnej (czerwone strzałki) z elementów, odróżniając je od siebie. Elektrony wypełniają orbitale związane z zasadą zlewu i zasady wykluczenia Paulinga (doskonale obserwowane od B do NE).
A co z liczbami kwantowymi? Definiują one każdą strzałkę - to znaczy każdy elektron - i jego wartości można potwierdzić z konfiguracją elektroniczną, aby wiedzieć, czy wartości z różnicowego elektronu są, czy nie.
Może ci służyć: jakie są negatywne skutki z rozpuszczalności w wodzie?Przykłady zróżnicowanych elektronów w kilku pierwiastkach
Chlor
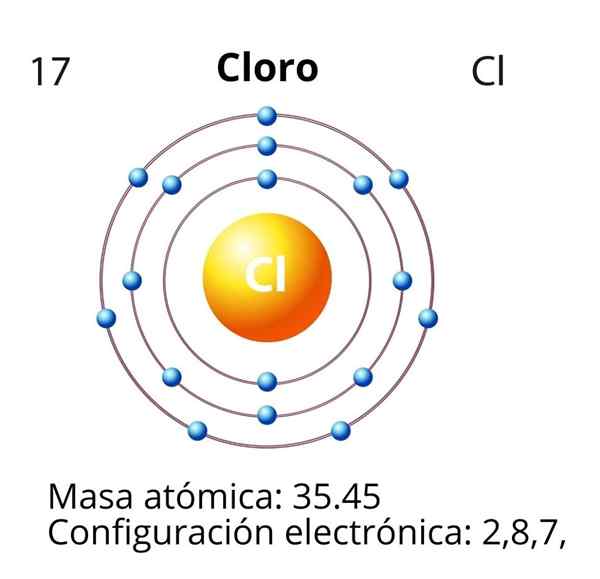
W przypadku chloru (CL) jego liczba atomowa Z jest równa 17. Konfiguracja elektroniczna wynosi następnie 1s22s2sp63s23p5. Orbitale zaznaczone na czerwono odpowiadają organom warstwy Walencji, która przedstawia otwarty poziom 3.
Różnicowy elektron jest ostatnim elektronem umieszczonym w konfiguracji elektronicznej, a atom chloru to orbital 3p, którego usposobienie jest następujące:
↑ ↓ ↑ ↓ ↑ _
3px 3py 3pz
(-1) (0) (+1)
Szanując zasadę zlewu, orbitale 3P są najpierw wypełnione równą energią (strzałka w górę na każdym orbicie). Po drugie, inne elektrony łączą się z samotnymi elektronami od lewej do prawej. Różnicowy elektron jest reprezentowany w zielonej ramie.
Zatem elektron różnicowy dla chloru ma następujące liczby kwantowe: (3, 1, 0, -1/2). To znaczy, „N” to 3; „L” to 1, Orbital „P”; „M” to 0, ponieważ jest to orbitalne „P” medium; I „s” to -1/2, ponieważ strzała wskazuje.
Magnez
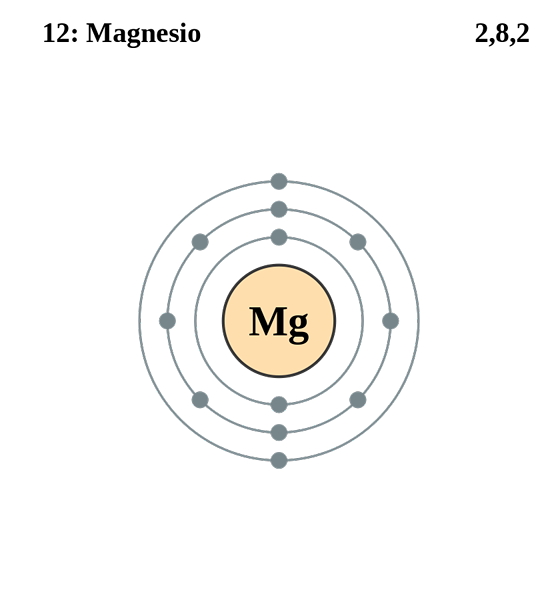 Elektroniczna konfiguracja magnezu. Źródło: electron_shell_012_magnesium.SVG: Pumbaa (Original Work Greg Robson) Praca pochodna: Kizar, CC BY-SA 3.0, Via Wikimedia Commons
Elektroniczna konfiguracja magnezu. Źródło: electron_shell_012_magnesium.SVG: Pumbaa (Original Work Greg Robson) Praca pochodna: Kizar, CC BY-SA 3.0, Via Wikimedia Commons Konfiguracja elektroniczna dla atomu magnezu wynosi 1s22s2sp63s2, Reprezentujący w ten sam sposób elektron orbital i jego walencji:
↑ ↓
3s
0
Tym razem elektron różnicowy ma liczby kwantowe 3, 0, 0, -1/2. Jedyną różnicą w tym przypadku w odniesieniu do chloru jest to, że liczba kwantowa „L” wynosi 0, ponieważ elektron zajmuje orbitalę „s” (3s).
Cyrkonio
Konfiguracja elektroniczna dla atomu cyrkonowego (przejściowy metal) wynosi 1s22s2sp63s23p64s23d104p65s24d2. W ten sam sposób, w jaki poprzednie przypadki reprezentacja orbitali i elektronów walencji jest następująca:
Może ci służyć: Cyclopentano (C5H10): Struktura, właściwości i zastosowania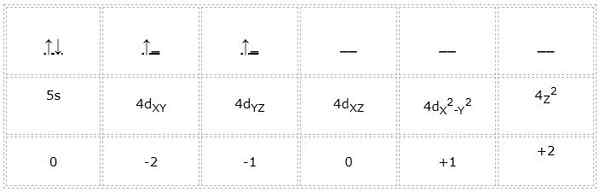
Zatem liczby kwantowe dla elektronu różnicowego oznaczonego na zielono wynoszą: 4, 2, -1, +1/2. Tutaj, ponieważ elektron zajmuje drugie orbital „D”, ma liczbę kwantową „M” równą -1. Ponadto, ponieważ strzałka wskazuje, jego liczba wirowania „s” jest równa +1/2.
Nieznany element
Liczby kwantowe elektronu różnicowego dla nieznanego elementu to 3, 2, +2, -1/2. Jaka jest liczba atomowa z elementu? Wiedząc, że Z może rozszyfrować, jaki jest element.
Tym razem, ponieważ „n” jest tym samym 3, oznacza to, że element znajduje się w trzecim okresie tabeli okresowej, z orbitalami „d” jako warstwa Valencia („l” równa 2). Dlatego orbitale są reprezentowane jak w poprzednim przykładzie:
↑ mechani
Liczby kwantowe „M” równe +2, a „S” równe -1/2, są kluczem do prawidłowego zlokalizowania elektronu różnicowego w ostatnim orbicie 3D 3D.
Zatem poszukiwany element ma orbitale 3D10 pełne, podobnie jak jego wewnętrzne warstwy elektroniczne. Podsumowując, elementem jest cynk metalowy (Zn).
Jednak liczba kwantowa elektronu różnicowego nie może rozróżniać między cynkiem a miedź, ponieważ ten ostatni element przedstawia również orbitale 3D. Ponieważ? Ponieważ miedź jest metalem, który zawodzi w zasadach wypełnionych elektronami z powodów kwantowych.
Bibliografia
- Jim Branson. (2013). Zasady. Pobrano z QuantumaMechanics.UCSD.Edu
- Wykład 27: Zasady Sink. Odzyskane po ph.Qmul.AC.Wielka Brytania
- Purdue University. Liczby kwantowe i konfiguracje elektronów. Pobrano z Murmed.Chem.Purdue.Edu
- Salvat Encyclopedia of Science. (1968). Salvat Physics, S.DO. of Pamplona Editions, tom 12, Hiszpania, s. 314-322.
- Walter J. Moore. (1963). Chemia fizyczna. W Cząsteczki i fale. Czwarta edycja, Longmans.

