Postać metaliczna
- 5068
- 871
- Eugenia Czapla
Jaki jest charakter metaliczny?
On Metaliczny charakter żywiołów Okresowa tabela odnosi się do wszystkich tych zmiennych, chemicznych i fizycznych, które definiują metale lub odróżniają je od innych substancji natury. Zazwyczaj są jasne, gęste, twarde, wysokie przewodnictwo termiczne i elektryczne, formalne i plastyczne.
Jednak nie wszystkie metale wykazują takie cechy; Na przykład w przypadku rtęci jest to jasna czarna ciecz. Również zmienne te zależą od warunków ciśnienia naziemnego i temperatury. Na przykład najwyraźniej niemetaliczny wodór może zachowywać się fizycznie jak metal w ekstremalnych warunkach.
Warunki te mogą być: pod ciśnieniem bezwzględnym lub bardzo niskimi temperaturami wokół absolutnego zera. Aby zdefiniować, czy element jest metaliczny, czy nie, należy rozważyć ukryte wzory w oczach obserwatora: wzorce atomowe.
Te dyskryminują większą precyzję i niezawodność, jakie są elementy metalowe, a nawet jaki element jest bardziej metaliczny niż inny.
W ten sposób prawdziwy metaliczny charakter złotej monety opiera się bardziej na cechach jej atomów niż tych określonych przez jej złotą masę, nawet oba są ściśle powiązane.
Które z monet jest bardziej metaliczne: jeden ze złota, jedna z miedzi lub platyny? Odpowiedź brzmi platyna, a wyjaśnienie leży w jej atomach.
Jak różni się metaliczny charakter pierwiastków w stole okresowej?
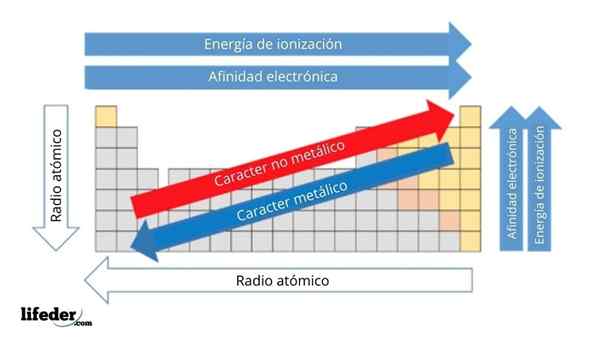
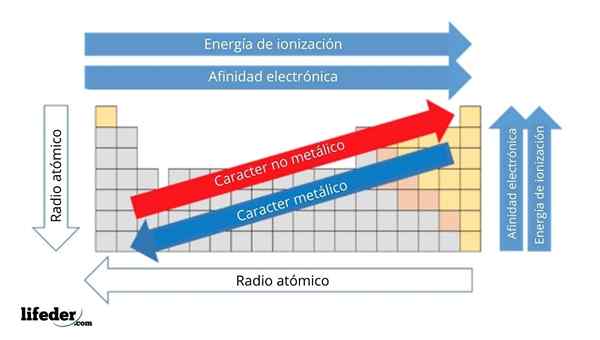
Na górnym obrazie masz okresowe właściwości elementów. Rzędy odpowiadają okresom i kolumnom grupom.
Znak metaliczny zmniejsza się od lewej do prawej od stolika okresowego i wzrasta w przeciwnym kierunku. Podobnie, metaliczny znak wzrasta od góry do dołu i maleje wraz z okresem przechodzących na główki grupowe.
Może ci służyć: podstawy: cechy i przykładyW ten sposób elementy zbliżone do kierunku, w którym wskazuje strzałka, mają większy charakter metaliczny niż te znajdujące się w przeciwnym kierunku (żółte bloki).
Dodatkowo pozostałe strzałki odpowiadają innym właściwościom okresowym, które definiują w jakim sensie, że zwiększają się lub zmniejszają, ponieważ element jest „metaliczny”. Na przykład elementy żółtych bloków, chociaż mają niski charakter metaliczny, ich elektroniczne powinowactwo i energia jonizacyjna są wysokie.
W przypadku radia atomowych, im większy, tym bardziej metaliczny jest element; Wskazuje to niebieska strzałka.
Właściwości elementów metalicznych
W tabeli okresowej zaobserwowano, że metale mają duże radiotelefony atomowe, niskie energie jonizacyjne, niskie powinowactwa elektroniczne i niskie elektroumeryzacje. Jak zapamiętać wszystkie te właściwości?
Punktem, do którego przepływają, jest reaktywność (elektropozytywność), która definiuje metale, które utleniają się; to znaczy łatwo tracą elektrony.
Kiedy tracą elektrony, metale tworzą kation (m+). Dlatego elementy o najwyższych metalowych katiach tworzą łatwiej niż elementy o niższym charakterze metalicznym.
Przykładem powyższego jest rozważenie reaktywności elementów grupy 2, metali alkalicznych. Beryl jest mniej metaliczny niż magnez, a to z kolei jest mniej metaliczne niż wapń.
Tak więc aż do dotarcia do metalowego Bario, najbardziej reaktywnego z grupy (po promieniu, element radioaktywny).
Jak wpływa promień atomowy na reaktywność metali?
Wraz ze wzrostem promienia atomowego elektrony Walencji są dalej od jądra, więc są zatrzymywane z mniejszą siłą w atomie.
Może ci służyć: wodorotlenek sodu (NaOH): struktura, właściwości, zastosowania, syntezaJeśli jednak okres jest przemieszczony po prawej stronie tabeli okresowej, jądro dodaje protony do swojego ciała, teraz bardziej dodatnie, co silniej przyciąga elektrony walencyjne, zmniejszając rozmiar promienia atomowego. Powoduje to zmniejszenie charakteru metalicznego.
Zatem bardzo mały atom i z bardzo dodatnim jądrem ma tendencję do zdobywania elektronów zamiast ich utraty (elementów niemetalicznych), a te, które mogą zarówno wygrać, jak i stracić elektrony, są uważane za metaloides. Bor, krzem, german i arsen to niektóre z tych metaloidów.
Z drugiej strony promień atomowy również wzrasta, jeśli istnieje nowa dostępność energii dla innych orbitali, która występuje podczas schodzenia w grupie.
Z tego powodu, gdy schodzą w stole okresowym, radia stają się nieporęczne, a rdzeń nie jest w stanie zapobiec wyroku innych gatunków z ich zewnętrznej warstwy.
W laboratorium, z silnym środkiem utleniającym podobnie jak rozcieńczonym kwasem azotowym (HNO3)- można badać reaktywność metalu w obliczu utleniania.
Podobnie procesy tworzenia ich halogenków metali (na przykład NaCl) są również demonstracyjnymi eksperymentami tej reaktywności.
Element większego metalicznego charakteru
 Cez
Cez Kierunek niebieskiej strzałki na obrazie okresowej tabeli prowadzi do elementów Francio i Cesio. Francio jest bardziej metaliczny niż cez, ale w przeciwieństwie do tego drugiego, Francio jest sztuczny i radioaktywny. Z tego powodu Cesium zajmuje miejsce naturalnego elementu o większym charakterze metalicznym.
Może ci służyć: tlenek żelazaW rzeczywistości jedna z najbardziej znanych (i wybuchowych) znanych reakcji jest ta, która występuje, gdy kawałek (lub krople) cezu wchodzi w kontakt z wodą.
Wysoka reaktywność cezu, również przełożona na tworzenie znacznie bardziej stabilnych związków, jest odpowiedzialna za nagłe uwolnienie energii:
2cs + 2H2O → 2CSOH (aq) + h2(G)
Równanie chemiczne pozwala zobaczyć utlenianie cezu i redukcję wodoru wodnego do wodoru gazowego.
Element niższego metalicznego charakteru
 Model fluoru 3D
Model fluoru 3D W przeciwnej przekątnej, w prawym górnym rogu stolika okresowego, fluorek (f2, Superior obraz) prowadzi listę elementów nie -metalowych. Ponieważ? Ponieważ jest to element w najbardziej elektroonegatywnej naturze i ten o najniższej energii jonizacji.
Innymi słowy, reaguje ze wszystkimi elementami stolika okresowego, tworząc jon f- i nie f+.
Fluor jest bardzo mało prawdopodobne, aby straciło elektrony w pewnej reakcji chemicznej, w przeciwieństwie do metali. Z tego powodu jest to element niższego charakteru metalicznego.
Bibliografia
- Lumen, Chemia dla nie-majster. Charakter metaliczny i niemetalny. Odzyskane z kursów.Lumenarning.com
- Przypisanie chemii. (2018). Elektropostywijność lub charakter metaliczny. Odzyskane z chemii.com
- Juan Ramos. Pełna lista metali i metali. Odzyskany z nauk przyrodniczych.com
- Anne Marie Helmestine, pH.D. Metaliczne właściwości i trendy. Wyzdrowiał z Thoughco.com

