Reakcje elektrofilowe, przykłady, elektrofilowość
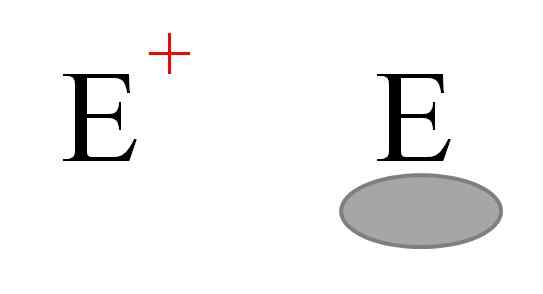
- 2290
- 124
- Herbert Wróblewski
A Elektrofil Wszystko, że gatunki chemiczne (atom lub cząsteczka) wygląda zręcznie kilka elektronów. Słowo oznacza „miłość do elektronów”. Dlatego elektreza zawsze wygrywa lub akceptuje elektrony podczas uczestnictwa w reakcjach chemicznych.
Co sprawia, że elektrofil potrzebuje elektronów? Musisz mieć niedobór elektronów, czy to przejawiony przez częściowe lub całkowite obciążenie dodatni. Oznacza to, że mamy kilka rodzajów elektrofilów, chociaż wszystkie one akceptują pary elektronów gatunków ujemnych.
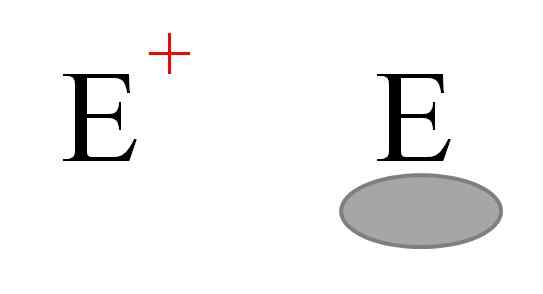 Dwa najczęstsze rodzaje elektrofilów w chemii. Źródło: Gabriel Bolívar.
Dwa najczęstsze rodzaje elektrofilów w chemii. Źródło: Gabriel Bolívar. Zwykle reprezentują dwa rodzaje elektrofilów. Oba są symbolizowane z literą i. Ten po lewej odpowiada elektrofii dodatnim i+. Tymczasem ten po prawej odpowiada elektrofilowi z elektronicznym wakatem, reprezentowanym przez szarawny owal, który wskazuje na brak elektronów na orbicie Walencji.
Katory metalowe są przykładami elektrofilów i+, a także niektóre jony poliatomiczne, takie jak hydronium, h3ALBO+. Cząsteczki ALH3 i BF3, Z drugiej strony są przykładami drugiego rodzaju elektrofilów, ponieważ zarówno aluminium, jak i atom boru mają niedobór elektronów, ponieważ nie uzupełniają oktetu walencji.
[TOC]
Reakcje
Elektrofile reagują akceptując pary elektronów atomowych o wysokich ujemnych gęstościach, to znaczy bogatych w elektron. Te ujemne atomy lub cząsteczki nazywane są nukleofilami, Nu-, które przekazują kilka elektronów elektrofii i e e+:
Gnu- + I+ → Nu-e
Jest to podstawa teoretyczna dla wielu reakcji organicznych, takich jak aromatyczne podstawienie elektrofilowe. Nukleofil niekoniecznie musi być anionem, ale może być również neutralną cząsteczką z atomem elektroonegatywnym, taką jak azot.
Może ci służyć: krzem: historia, właściwości, struktura, uzyskiwanie, użyciaPrzykłady elektrofilów
Kwasy Lewisa
Kwasy Lewisa są elektrofilami, ponieważ z definicji akceptują pary elektronów. Katory metaliczne, mN+, Przyciągnij negatywne regiony otaczających cząsteczek polarnych w procesach solwatacji. Zatem mN+ ostatecznie otaczają obciążenia ujemne, a nawet przyjęcie elektronów w celu tworzenia kompleksów koordynacyjnych.
Cucion Cu2+, Na przykład jest to kwas Lewisa i elektrofil, ponieważ jest on skoordynowany z atomami tlenu z wodą, tworząc złożony ACU2)62+. W ten sam sposób, w jaki zdarza się to z innymi kationami.
Nie wszystkie kwasy Lewisa są kationami: niektóre są obojętnymi cząsteczkami lub atomami. Na przykład BF3 Jest to kwas Lewisa i elektrofil, ponieważ.
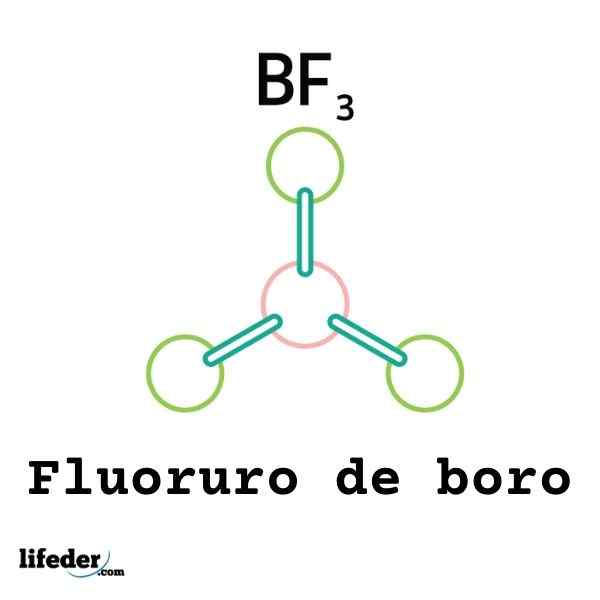
W ten sposób połączy się z otaczającym anionem fluorowym, aby utworzyć anion Boro tetrafluoruro, BF4-. To znaczy BF3 tworzy link do F- akceptując kilka ich elektronów.
Kolejną elektrezą jest Nitronio Ion, nie2+, który jest Środek elektrofiliczny bardzo silne utworzone w reakcjach nitracyjnych benzenu. W tym jonie atom azotu ma dodatnie obciążenie, więc elektrony benzenowe szybko akceptują.
Brönsted Acids
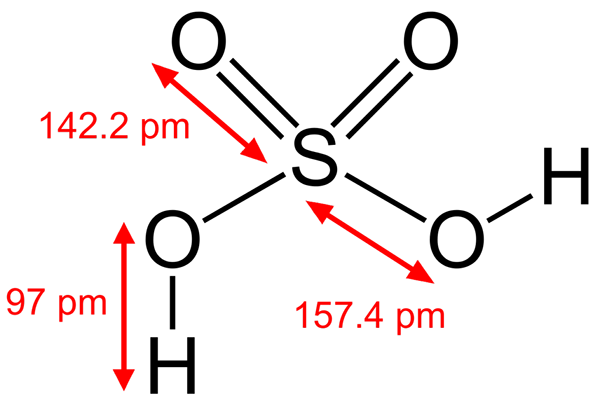 Struktura kwasu siarkowego
Struktura kwasu siarkowego Niektóre kwasy BrönsteD są również elektrofilami. Na przykład kation hydroniowy, h3ALBO+, Jest to elektrofil, ponieważ atom tlenu ma dodatnie obciążenie. Będąc bardzo elektroonywentą, będziesz starał się zdobyć elektrony przekazujące jeden z jego hydrogenów na przekształcenie w cząsteczkę wody.
Kolejny kwas Brönsted, taki jak kwas siarkowy, H2południowy zachód4, Jest to również elektrofil. Atom siarki jest wysoce utleniony i będzie starał się zdobyć elektrony przekazujące dwa hydrogeny.
Może ci służyć: tetrachlor węglowy (CCL4)Halogeny
Halogeny (f2, Cl2, Br2 i ja2) Są elektrofilami. Jego atomy nie mają braków elektronicznych; Jednak ich linki są niestabilne, ponieważ oba atomy, X-X, bardzo mocno przyciągają do nich elektrony.
Dlatego halogeny reagują jako środki utleniające, zachowując się jako elektrofilki i akceptując pary elektronów, aby stać się halogennymi anionami (F-, Cl-, Br- i ja-).
Jednak halogeny nie tylko wygrywają w ten sposób elektrony. Można je również powiązać z mniejszymi atomami elektroungatywnymi niż one w celu uzyskania wzmocnienia elektronów netto. Na przykład jest to powód, dla którego można je dodać do podwójnych wiązań alkenów lub olefin.
Halogeny reprezentują inny rodzaj elektroody niż dwa, które zostały wprowadzone na początku. Jednak jego zachowanie na końcu jest takie samo jak dla wszystkich elektrofilów: akceptuj pary elektronów.
Halogendy czynszowe i wodorowe
 Cząsteczki CFC to halogenki alkilowe
Cząsteczki CFC to halogenki alkilowe Czynsz i halogenki wodorowe to elektrofile, w których atom połączony halogenowo ma silny niedobór elektroniczny reprezentowany przez symbol δ+. Wynika to z faktu, że halogen, wysoce elektroonywalny, przyciąga do siebie gęstość elektroniczną sąsiedniego atomu.
W przypadku halogenków alkilowych Rx, R będzie miał niedobór elektroniczny, podczas gdy x nadmiar elektronów, rδ+-Xδ-. Tak więc, jeśli bardzo negatywny gatunek zbliży się do Rx, zaatakuje R, aby połączyć się z nim i sprawić, że X wyjdzie jako anion.
Ponadto w halogenkach wodoru HX, wodór ma niedobór elektroniczny lub dodatnie obciążenie częściowe, H, Hδ+-Xδ-. Dlatego ujemne gatunki przyniosą swoje elektronom temu wodoru, a on jako elektrofil je zaakceptuje.
Związki karbonylowe
Kwasy, halogeny i halogenki nie są jedynymi cząsteczkami, które można zaklasyfikować jako elektrofilki. Nawet jeśli nie, dwutlenek węgla, co2, Jest to elektrofil, ponieważ centralny atom węgla jest bardzo utleniony, OR = Cδ+= O.
Może ci służyć: płaskie kolbę tłaDlatego kiedy Co -2 Reacta zrobi to akceptując pary elektronów, stając się karboksylanem, grupą COOH lub anionem węglanowym, co32-.
Oprócz CO2, Związki karbonylowe, takie jak ketony, aldehydy i estry, są również przykładami elektrofilów, ponieważ w nich węgiel ma dodatnie obciążenie częściowe i ma tendencję do przyjmowania elektronów gatunków bardzo ujemnych.
Karbokacje
 Atom węgla metanu pozytywnie załadowany
Atom węgla metanu pozytywnie załadowany Karbokacje są niezwykle silnymi kwasami Lewisa. Istnieje trzeciorzęd3C+), wtórny (r2HC+) lub podstawowe (RH2C+). Węgiel zawsze tworzy cztery wiązania, więc w szczególności ten kation będzie szukał w jakikolwiek sposób zaakceptowania elektronów.
Elektrofilowość
Nie wszystkie elektrofile są równie „głodne” przez elektrony. Niektóre są bardziej reaktywne niż inne. Im większy elektroniczny niedobór elektrofilu, tym większa jego wrażliwość na cierpieć nukleofilowe ataki gatunków ujemnych. Oznacza to, że będzie to większa elektrofilizacja, co jest względną miarą tego, jak reaktywny jest dany elektrofil.
Na przykład karbokacje, nitron i fluor mają wysoką elektrofilację; Podczas gdy dwutlenek węgla lub niektóre kationy, takie jak sód, mają niski poziom elektrofilacyjny.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10. edycja.). Wiley Plus.
- Wikipedia. (2020). Elektrofil. Źródło: w:.Wikipedia.org
- James Ashenhurst. (2020). Nukleofile i elektrofile. Odzyskane z: MastorganicChemistry.com
- Profesor Patricia Shaley. (2012). Nukleofile i elektrofile. University of Illinois. Wyzdrowiał z: butanu.Chem.UIUC.Edu
- Danielle Reid. (2020). Elektrofil: definicja i przykład. Badanie. Odzyskane z: Study.com
- Tim Soderberg. (7 października 2019). Elektrofile. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- « Formuła prawa biot-savart, demonstracja, aplikacje, ćwiczenia
- Prawo tolerancji Shelford, co polega na i przykładach »

