Darmstadtio Discovery, struktura, właściwości, użycia

- 1633
- 290
- Gabriela Łuczak
On Darmstadtio Jest to ultra ciężki element chemiczny zlokalizowany w serii Transactinid, który rozpoczyna się tuż po metalowi Lawrencio. Jest to konkretnie w grupie 10 i okresie 7 stolika okresowego, będąc kongenerami metali niklu, paladu i platyny.
Ma symbol chemiczny o liczbie atomowej 110, a jego bardzo niewiele atomów, które zsyntetyzowały, są praktycznie rozkładane natychmiast. Jest to zatem efemeryczny element. Syntetyze i wykrycie, stanowił wyczyn w latach 90. ubiegłego wieku, uznając jego odkrycie grupę niemieckich badaczy.
 Element Darmstadtio został odkryty w niemieckim instytucie GSI, w mieście Darmstadt. Źródło: Commander-Pirx w niemieckiej Wikipedii [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Element Darmstadtio został odkryty w niemieckim instytucie GSI, w mieście Darmstadt. Źródło: Commander-Pirx w niemieckiej Wikipedii [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)] Przed jego odkryciem i że omówiono, jak powinien być jego imię, system nomenklatury IUPAC formalnie nazwał „Unaunilio”, co oznacza „One-One-Zero”, równy 110. I dalej za tą nomenklaturą, według systemu Mendeleeva, jego nazwa brzmiała Eka-Platino dla chemicznego myślenia o tym metalu.
Darmstadtio jest elementem nie tylko efemerycznym i niestabilnym, ale także wysoce radioaktywnym, w których jądrze rozpada większość jego izotopów uwalniających cząstki alfas; To są, helio nagie jądra.
Ze względu na jego ulotne życie wszystkie jego nieruchomości są szacowane i nigdy nie można ich używać w określonym celu.
[TOC]
Odkrycie
Niemiecki zasługa
Problem związany z odkryciem Darmstadtio polegał na tym, że kilka zespołów badaczy poświęciło się syntezy w kolejnych latach. Gdy tylko powstał jego atom, zniknął w napromieniowanych cząstkach.
Dlatego nie można było po omacku, który z zespołów zasłużył na uznanie dla syntetyzowania pierwszego, gdy nawet wykrywanie go już stanowiło wyzwanie, malejąc tak szybko i wydając produkty radioaktywne.
Może ci służyć: kwas taniowy: struktura, właściwości, uzyskiwanie, zastosowaniaW syntezie Darmstadtio pracowali przez oddzielne zespoły z następujących ośrodków śledczych: Central Institute of Nuclear Research w Dubná (do ówczesnego Związku Radzieckiego), Lawrence Berkeley National Laboratory (Stany Zjednoczone) i Centrum Badań Jonów ciężkich (skrócone w języku niemieckim jako GSI ).
GSI znajduje się w niemieckim mieście Darmstadt, gdzie w listopadzie 1994 269Ds. Inne zespoły zsyntetyzowały inne izotopy: 267DS w iCin i 273DS w LNLB; Jednak jego wyniki nie były rozstrzygające w krytycznych oczach IUPAC.
Każdy zespół zaproponował konkretną nazwę tego nowego elementu: Hahnio (ICIN) i Bequerelio (LNLB). Ale po raporcie IUPAC w 2001 r. Niemiecki zespół GSI miał prawo wyznaczyć element Darmstadtio.
Synteza
Darmstadtio jest produktem fuzji atomów metali. Który? Zasadniczo stosunkowo ciężki, który służy jako biały lub cel, a kolejne światło, które zostanie zderzone z pierwszą z prędkością równą dziesiątej prędkości światła w próżni; W przeciwnym razie nie można pokonać odpychania między dwoma jąderkami.
Gdy dwa jądra zderzyją się skutecznie, nastąpi reakcja fuzji jądrowej. Protony dołączają, ale los neutronów jest inny. Na przykład GSI opracował następującą reakcję jądrową, z której wystąpił pierwszy atom 269DS:
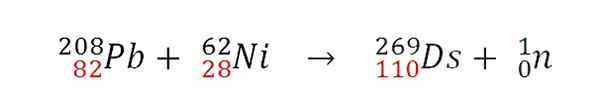 Reakcja jądrowa na syntezę atomu izotopowego 269DS. Źródło: Gabriel Bolívar.
Reakcja jądrowa na syntezę atomu izotopowego 269DS. Źródło: Gabriel Bolívar. Zauważ, że dodawane są protony (na czerwono). Zmieniając masy atomowe zderzczonych atomów, uzyskuje się różne izotopy Darmstadtio. W rzeczywistości GSI przeprowadził eksperymenty z izotopem 64Ani zamiast 62Ani z tych, którzy syntetyzowali tylko 9 atomów izotopu 271Ds.
Może ci służyć: aldehydoGSI udało się stworzyć 3 atomy 269DS, ale po wykonaniu trzech bilionów bombardowań na sekundę przez cały tydzień. Dane te oferują przytłaczającą perspektywę wymiarów takich eksperymentów.
Struktura Darmstadtio
Ponieważ tylko atom Darmstadtio na tydzień może zostać zsyntetyzowany lub stworzony, jest mało prawdopodobne, aby miał wystarczająco dużo, aby ustalić kryształ; Nie wspominając o tym, że najbardziej stabilnym izotopem jest 281DS, którego T1/2 To tylko 12,7 sekundy.
Dlatego, aby określić ich strukturę krystaliczną, naukowcy opierają. Zatem oszacowano, że struktura Darmstadtio jest sześcienna skoncentrowana na ciele (BCC); W przeciwieństwie do ich najbardziej lekkich niklu, paladu i platynowych kongenerów, z strukturami sześciennymi wyśrodkowanymi na twarzach (FCC).
Teoretycznie najbardziej zewnętrzne elektrony orbitali 6D i 7s muszą uczestniczyć w ich metalowym łącze, zgodnie z ich szacunkową konfiguracją elektroniczną:
[RN] 5f146d87s2
Prawdopodobnie jednak poznaje eksperymentalnie z fizycznych właściwości tego metalu.
Nieruchomości

Pozostałe właściwości Darmstadtio są również szacowane z tych samych powodów, dla których wspomniano o jego strukturze. Jednak niektóre z tych szacunków są interesujące. Na przykład Darmstadtio byłby jeszcze bardziej szlachetny metal niż złoto, a także bardzo gęsty (34,8 g/cm3) że Osmium (22,59 g/cm3) i El Mercurio (13,6 g/cm3).
Jeśli chodzi o możliwe stany utleniania, oszacowano, że będzie to +6 (DS6+), +4 (DS4+) i +2 (DS2+), równe z ich lżejszych rówieśników. Dlatego jeśli atomy 281DS przed rozpadem, uzyskanoby takie związki, takie jak DSF6 lub DSCL4.
Może ci służyć: 50 przykładów kwasów i podstawCo zaskakujące, istnieje prawdopodobieństwo zsyntetyzowania tych związków, ponieważ 12,7 sekundy, T1/2 z 281DS, to więcej niż czas na reakcje. Jednak niedogodności nadal jest to, że przy tylko atomie DS tygodniowo nie jest wystarczające zebranie wszystkich danych wymaganych przez analizę statystyczną.
Aplikacje
Ponownie, ponieważ jest to tak rzadki metal, obecnie syntetyzowany w ilościach atomowych, a nie masywnych, nie ma dla niego zarezerwowania; Nawet w odległej przyszłości.
O ile nie jest to metoda stabilizacji izotopów radioaktywnych, atomy Darmstadtio zostaną wykorzystane wyłącznie do wzbudzania ciekawości naukowej, szczególnie w odniesieniu do fizyki jądrowej i chemii.
Ale jeśli zarządzanie ich w obfitej ilościach będzie w jakikolwiek sposób, w jakikolwiek sposób na chemię tego ultra ciężkiego i efemerycznego elementu zostanie wyrzucona więcej świateł.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Darmstadium. Źródło: w:.Wikipedia.org
- Steve Gagnon. (S.F.). Element Darmstadium. Jefferson Lab Resource. Odzyskane z: edukacja.Jlab.org
- National Center for Biotechnology Information. (2020). Darmstadium. Baza danych Pubchem. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Brian Clegg. (15 grudnia 2019 r.). Darmstadium. Chemia w swoich pierwiastkach. Odzyskane z: ChemistryWorld.com
- « Koncepcja numeru utleniania, jak to wyciągnąć i przykłady
- Masa molowa Jak jest obliczana, rozwiązane przykłady i ćwiczenia »

