Chrom (CR)

- 950
- 226
- Estera Wojtkowiak
 Chrom jest bardzo reaktywny metal. Wikimedia Commons
Chrom jest bardzo reaktywny metal. Wikimedia Commons Co to jest Chrome?
On chrom (Cr) jest elementem chemicznym grupy 6 (VIB) tabeli okresowej. Corocznie tony tego metalu są wytwarzane przez ekstrakcję chromu lub minerału magnezu (Fecer2ALBO4, MGCR2ALBO4), które są zmniejszone z węglem w celu uzyskania metalu. Jest bardzo reaktywny i tylko w bardzo redukujących warunkach jest w czystej formie.
Jego minerały i tlenki, a także niewielka metaliczna miedziana część, sprawiają, że ten element zajmuje numer 22 najliczniejszej kory Ziemi.
Chemia chromu jest bardzo zróżnicowana, ponieważ może tworzyć linki z prawie całym stołem okresowym. Każdy z jego związków wykazuje kolory, które zależą od liczby utleniania, a także od gatunków, które z nim oddziałują.
Ponadto formularze z węglem, interweniując w dużej liczbie związków organetalicznych.
Chromowe charakterystyki i właściwości
Chrom jest metalem srebrnym w czystej postaci, z atomową liczbą 24 i masą cząsteczkową około 52 g/mol (52CR, jego najbardziej stabilny izotop).
Biorąc pod uwagę jego mocne metalowe łącza, przedstawia punkty fusion (1907 ° C) i gotowanie (2671 ° C) wysokie. Ponadto jego krystaliczna struktura czyni go bardzo gęstym metalem (7.19 g/ml).
Nie reaguje z wodą z tworzenia wodorotlenków, ale z kwasami. Utlenia się tlenem powietrza ogólnie wytwarzającego tlenek chromowy, który jest szeroko stosowanym zielonym pigmentem.
Te warstwy tlenku tworzą tak zwane Pasywacja, Ochrona metalu przed kolejnymi korozjami, ponieważ tlen nie może przenikać do zatoki metalowej.
Jego konfiguracja elektroniczna to [AR] 4S13d5, Ze wszystkimi brakującymi elektronami, a zatem wykazuje właściwości paramagnetyczne. Jednak kojarzenie spinów elektronicznych może wystąpić, jeśli metal jest poddawany niskim temperaturze, nabywając inne właściwości, takie jak antyferromagnetyzm.
Może ci służyć: materiały ogniotrwałeChemiczna struktura chromu
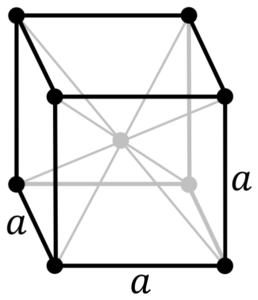 Chrome Metal Structure. Źródło: autor: oryginalne PNGS Daniel Mayer, Drbob, Wikimedia Commons
Chrome Metal Structure. Źródło: autor: oryginalne PNGS Daniel Mayer, Drbob, Wikimedia Commons Jaka jest struktura chromu metalu? W czystej postaci chrom przyjmuje sześcienną strukturę krystaliczną wyśrodkowaną na ciele (CC lub BCC). Oznacza to, że atom chromowy znajduje się w centrum kostki, którego krawędzie są zajęte przez inne chromy (jak na obrazie wyższym).
Ta struktura jest odpowiedzialna za chrom o wysokich punktach topnienia i wrzenia, a także za wielką twardość. Atomy miedziane nakładają się na ich orbitale S i D, tworząc zespoły napędowe zgodnie z teorią zespołu.
Zatem oba pasma są pełne w połowie, ponieważ ich konfiguracja elektroniczna wynosi [AR] 4S13d5, I jako Orbital, mogą pomieścić dwa elektron i orbitale dziesięciu. Następnie tylko połowa pasm utworzonych przez ich nakładanie się zajmuje elektrony.
Z tymi dwiema perspektywami -struktura krystaliczna i metaliczny ogniwo -wiele właściwości fizycznych tego metalu można wyjaśnić teoretycznie. Jednak żadne z nich nie wyjaśnia, dlaczego chrom może mieć kilka stanów lub liczby utleniania.
W tym celu głębokie zrozumienie stabilności atomu w odniesieniu do spinów elektronicznych.
Numer utleniania chromu
Ponieważ chromowana konfiguracja elektroniczna to [AR] 4S13d5 Możesz wygrać do jednego lub dwóch elektronów (Cr1- i cr2-) lub utrata ich w celu uzyskania różnych liczb utleniania.
Zatem, jeśli chrom straci elektron, byłby to jako [AR] 4s03d5; Jeśli stracisz trzy, [AR] 4s03d3; A jeśli stracisz je wszystkie, [AR] lub to, co jest takie samo, argon byłoby izolektroniczne.
Może ci służyć: Pojęcie wrzenia: koncepcja, obliczenia i przykładyChrom nie traca ani nie zyskuje elektronów z powodu samego kaprysu: musi istnieć gatunek, który wykonał lub zaakceptował je z jednego numeru utleniania do drugiego.
Chrom ma następujące liczby utleniania: -2, -1, 0, +1, +2, +3, +4, +5 i +6. Z nich +3, cr3+, Jest najbardziej stabilny, a zatem dominujący ze wszystkich; a następnie +6, Cr6+.
Zastosowania chromu
Jako barwnik lub pigment
Chrom ma szeroki zakres zastosowań, od barwnika dla różnych rodzajów tkanin, po obrońcę, który upiększają części metalowe, w tak zwanym chromie, które można wykonać za pomocą czystego metalu lub związkami CR (III) lub Cr (III) lub Cr (III) lub Cr (III) lub Cr (Vi).
Fluoruro cromic (CRF3) na przykład jest używany jako barwnik wełniany tkaniny; Siarczan kromowy (cr2(POŁUDNIOWY ZACHÓD4)3), przeznaczony jest do kolorowania emaliów, ceramiki, obrazów, atramentów, lakierów, a także służy do metali chromarowych; i tlenek chromowy (Cr2ALBO3) Znajdź również zastosowanie tam, gdzie wymagany jest jego atrakcyjny zielony kolor.
Dlatego każdy chromowy minerał o intensywnych kolorach może być przeznaczony do farbowania struktury, ale potem fakt, czy te związki są niebezpieczne, czy nie dla środowiska, czy dla zdrowia jednostek.
W rzeczywistości jego trujące właściwości są używane do oszczędzania drewna i innych powierzchni ataku owadów.
W chromowanych lub metalurgii
Podobnie dodaje się niewielkie ilości chromu do stali, aby wzmocnić go w obliczu utleniania i poprawić jego jasność. Dzieje się tak, ponieważ jest w stanie tworzyć szare węgliki (Cr3C2) Bardzo odporne podczas reakcji z tlenem powietrza.
Może ci służyć: wodorotlenek wapnia (CA (OH) 2): Struktura, właściwości, uzyskiwanie, zastosowaniaPonieważ chrom może polerować aż do jasnych powierzchni, chromu następnie przedstawić srebrne wzory i kolory jako tańszą alternatywę do tych celów.
Żywieniowe
Pewna debata, czy chrom można uznać za niezbędny element, to znaczy niezbędne w codziennej diecie. Jest obecny w niektórych produktach w bardzo małych stężeniach, takich jak zielone liście i pomidory.
Istnieją również suplementy białkowe, które regulują aktywność insuliny i faworyzują wzrost mięśni, jak ma to miejsce w przypadku chromu policykotynato.
Gdzie jest chrom?
Chrom występuje w dużej różnorodności minerałów i klejnotów, takich jak rubiny i szmaragdy. Głównym minerałem, z którego ekstrahuje się chrom, jest chromit (MCR2ALBO4), Gdzie m może być dowolnym innym metalem, z którym powiązany jest tlenek chromu. Kopalnie te obfitują w Południowej Afryce, w Indiach, Turcji, Finlandii, Brazylii i innych krajach.
Każde źródło ma jeden lub więcej wariantów chromu. W ten sposób dla każdego M (wiara, Mg, Mn, Zn itp.) Powstaje inny chromowany minerał.
Aby wydobyć metal, jest to konieczne. Odbywa się to z węglem lub aluminium:
Fecr2ALBO4 + 4c => Fe + 2cr + 4co
Podobnie znaleziono chromita (pbcro4).
Zwykle w każdym minerałach, w którym jon cr3+ może zastąpić Al3+, Oba z nieco podobnymi radia jonowe stanowi zanieczyszczenie, które skutkuje kolejnym naturalnym źródłem tego niesamowitego, ale szkodliwego metalu.
Bibliografia
- Tenebaum e. Chrom. Zaczerpnięte z: chemii.Pomona.Edu
- Chemia librettexts. Chemia chromu. Zaczerpnięte z: chem.Librettexts.org
- Chrom. Zaczerpnięte z: ChemistryExplaed.com

