Mechanizmy korozji galwanicznej, przykłady, ochrona

- 2562
- 163
- Paweł Malinowski
Korozja galwaniczna lub elektrochemiczna Jest to proces, w którym metal lub stop jest degradowany bardziej zawroty głowy w porównaniu z konwencjonalnym utlenianiem. Można powiedzieć, że jest to przyspieszone utlenianie, a nawet celowo prowadzone; Jak w bateriach lub bateriach.
Odbywa się to w serii warunków. Po pierwsze, musi być aktywny metal, zwany anodą. Również, a po drugie, musi być trochę reaktywny szlachetny metal zwany katodą. Trzeci i czwarty warunki to obecność pożywki, w której rozkładane są elektrony, takie jak woda, i gatunki jonowe lub elektrolitowe.
 Utleniona korona żelazna. Źródło: Pixnio.
Utleniona korona żelazna. Źródło: Pixnio. Korozja galwaniczna jest zaobserwowana, szczególnie w środowiskach morskich lub na brzegach plaż. Prądy powietrzne podnoszą masy pary wodnej, które z kolei przeciągają niektóre jony; Ten ostatni kończy się cienką warstwą wody lub kropli, które spoczywają na metalowej powierzchni.
Te warunki wilgotności i zasolenia sprzyjają korozji metalowej. Oznacza to, że żelazna korona taka jak ta na górnym obrazie utlenia się szybciej, jeśli zostanie narażona na pobliskie morze.
Łatwość, którą metal będzie musiał utlenić w porównaniu z innym, można zmierzyć ilościowo poprzez jego potencjały redukcyjne; W książkach chemii jest wiele tabel z tymi potencjałami i. Im bardziej negatywny, tym większa twoja skłonność do utleniania.
Ponadto, jeśli ten metal jest w obecności innego o bardzo pozytywnym potencjale redukcji, a zatem mając duży ΔE, utlenianie reaktywnego metalu będzie bardziej agresywne. Ważne są również inne czynniki, takie jak pH, siła jonowa, wilgotność, obecność tlenu i związek między obszarami tleśnionego metalu a tym, który jest zmniejszony, są również.
[TOC]
Mechanizmy
Pojęcia i reakcje
Przed zajęciem się mechanizmami stojącej za korozją galwaniczną należy wyjaśnić pewne pojęcia.
W reakcji gatunek A traci elektrony (utlenione), podczas gdy inny je wygrywa (jest zmniejszony). Elektroda, na której się dzieje, nazywa się anodą; I na którym następuje redukcja, zwykle stosuje się katodę (w języku angielskim nemoniczny Czerwony Kot zapamiętać).
Zatem dla elektrody (jeden kawałek, śruba itp.) z metalu m, jeśli jest to utleniane, mówi się, że jest to anoda:
M => mN+ + ne-
Liczba uwalnianych elektronów będzie równa wielkości dodatnim obciążenia kationu mN+ wynikły.
Następnie inna elektroda lub metale (oba metale muszą być w jakiś sposób kontaktowe), odbiera uwalniane elektrony; Ale nie ma to reakcji chemicznej, jeśli zyskują elektrony, ponieważ prowadziłby je tylko (prąd elektryczny).
Dlatego musi istnieć inny gatunek w roztworze, który elektrony te mogą formalnie zaakceptować; Na przykład jako łatwe do zmniejszenia jonów metali:
Może ci służyć: system niejednorodnyRN+ + ne- => R
Oznacza to, że powstałaby warstwa metalowego R, a elektroda stałaby się cięższa; podczas gdy metal M straciłby masę, ponieważ ich atomy rozpuszczają się.
Depolaryzatory
A gdyby nie było metalowych kationów, które można było wystarczająco zmniejszyć? W takim przypadku inne gatunki obecne pośrodku wezmą elektrony: Depolaryzadory. Są one ściśle powiązane z pH: o2, H+, Oh- i H2ALBO.
Tlen i woda zyskują elektrony w reakcji wyrażonej przez następujące równanie chemiczne:
ALBO2 + 2h2O + 4e- => 4oh-
Podczas gdy Iones h+ Przekształcają się w h2:
2h+ + 2e- => H2
To znaczy gatunek- i H2 Są to powszechne produkty korozji galwanicznych lub elektrochemicznych.
Nawet jeśli metal R nie uczestniczy w żadnej reakcji, fakt, że jest bardziej szlachetny, że M promuje jego utlenianie; I w konsekwencji nastąpi większa produkcja jonów OH- o Gaz wodoru. Ponieważ w końcu jest to różnica między potencjałami redukcji, ΔE, jednym z głównych silników tych procesów.
Żelazna korozja
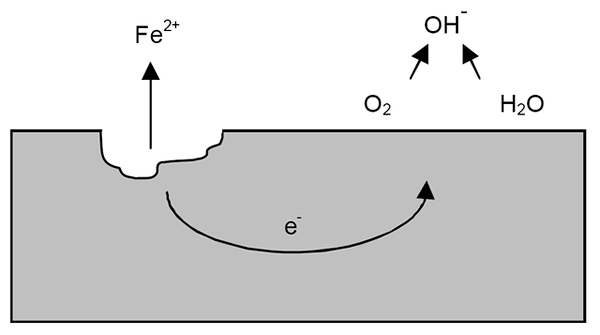 Mechanizm korozji żelaza. Źródło: Wikipedia.
Mechanizm korozji żelaza. Źródło: Wikipedia. Po poprzednich wyjaśnieniach można rozwiązać przykład korozji żelaza (obraz wyższy). Załóżmy, że istnieje cienka warstwa wody, w której rozpuszcza się tlen. Bez obecności innych metali, będzie to depolaryzadorzy, które oznaczają wytyczne reakcji.
Tak więc żelazo straci niektóre atomy na swojej powierzchni, aby rozpuścić w wodzie jako kationów wiary2+:
Fe => wiara2+ + 2e-
Dwa elektrony pokonują żelazny kawałek do bycia dobrym przewodnikiem elektrycznym. Tak, że wiadomo, gdzie zaczęło się utlenianie lub miejsce anodowe; Ale nie gdzie będzie kontynuowana redukcja lub lokalizacja miejsca katodowego. Strona katodowa może być wszędzie; A im wyższy jego możliwy obszar, gorsza będzie korozja metalu.
Załóżmy, że elektrony osiągają punkt, jak pokazano na górnym obrazie. Tam zarówno tlen, jak i woda cierpią z powodu opisanej już reakcji, w której OH jest uwalniany-. Te aniony Och- Mogą reagować z wiarą2+ Tworzyć wiarę (oh)2, który wytrąca się i cierpi z późniejszych utleniania, które ostatecznie przekształcają go w rdzę.
Tymczasem witryna anodowa coraz bardziej pęka.
Przykłady
W życiu codziennym przykłady korozji galwanicznych są liczne. Nie musimy odnosić się do żelaznej korony: każdy artefakt wykonany z metali może ponieść ten sam proces w obecności środowiska mokrego i soli fizjologicznej.
Może ci służyć: grupa fosforanowaOprócz plaży zima może również przyczynić się do idealnych warunków korozji; Na przykład, gdy rzucasz sole na śnieg drogowy, aby zapobiec łyżkom samochodów.
Z fizycznego punktu widzenia, w spawanych związkach dwóch metali może zachować wilgoć, będąc aktywnymi miejscami korozji. Wynika to z faktu, że oba metale zachowują się jak dwie elektrody, a najbardziej reaktywne straci elektrony.
Jeśli produkcja jonowa- Jest to znaczne, możesz nawet uruchomić farbę samochodu lub przedmiotowy artefakt.
Wskaźniki anodowe
Można zbudować własne przykłady korozji galwanicznych przy użyciu tabel potencjalnych redukcji. Jednak tabela indeksu anodowego (uproszczona przez samą) zostanie wybrana w celu zilustrowania tego punktu.
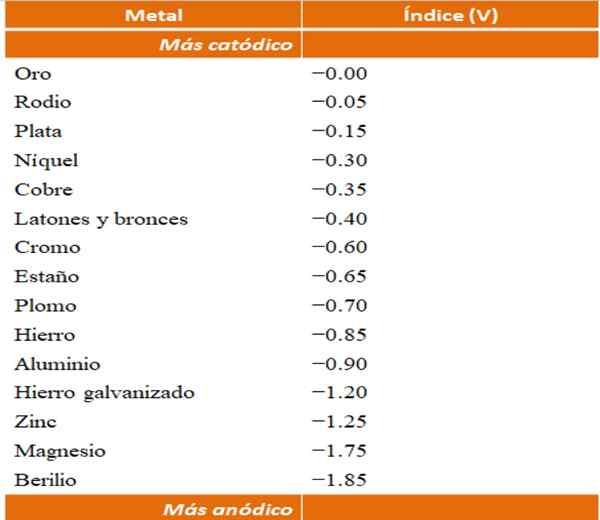 Wskaźniki anodowe dla różnych metali lub stopów. Źródło: Wikipedia.
Wskaźniki anodowe dla różnych metali lub stopów. Źródło: Wikipedia. Załóżmy, że na przykład chcielibyśmy zbudować komórkę elektrochemiczną. Metale, które są górną częścią tabeli indeksów anodowych, są bardziej katodami; Oznacza to, że można je łatwo zmniejszyć, a zatem trudno będzie je mieć w roztworze. Podczas gdy metale na dole są bardziej anodowe lub odczynniki i łatwo działają.
Jeśli wybierzemy złoto i beryl, oba metale nie mogłyby być razem przez długi czas, ponieważ berylle utlenia się z ekstremalnym szybkim.
A jeśli wręcz przeciwnie, mamy rozwiązanie agonowe+ I zanurzamy w nim aluminiowy pasek, rozpuszcza się w tym samym czasie, który wytrącał się z metalowymi cząstkami srebra. Jeśli ten pasek połączy się z elektrodą grafitową, elektrony podróżują do niej do elektrochemicznie osadzania srebra jak srebrna folia.
A jeśli zamiast aluminiowego paska nie jest miedzi, roztwór stałby się niebieskawy przez obecność jonów Cu2+ w wodzie.
Ochrona przed korozją elektrochemiczną
Poświęcić powłoki
Załóżmy, że ma na celu ochronę blaszki korozji w obecności innych metali. Najłatwiejszą opcją byłoby dodanie magnezu, które pokryłoby cynk, aby po utlenianiu elektrony uwalniane z magnezu zmniejszają kation Zn2+ z powrotem.
Jednak film MGO o cynku wcześniej niż później skończyłby pękanie, zapewniając witrynę prądu o wysokiej gęstości; to znaczy korozja cynku gwałtownie przyspieszyłaby w tych punktach.
Ta technika ochrony przed korozją elektrochemiczną jest znana jako stosowanie okładziny poświęcenia. Najbardziej znany jest cynk, stosowany w słynnej technice zwanej galwanizacją. W nich metal M jest pokryty, zwłaszcza żelazo, cynk (wiara/Zn).
Może ci służyć: fenolphtaleina (C20H14O4)Ponownie, cynk utlenia się, a jego tlenek służy do pokrycia żelaza i transmisji elektronów, które zmniejszają wiarę2+ które można utworzyć.
Szlachetne powłoki
Załóżmy, że ponownie chcesz chronić ten sam arkusz cynku, ale teraz chrom będzie używany zamiast magnezu. Chrom jest bardziej szlachetny (bardziej katod, patrz tabela wskaźników anodowych) niż cynk, i dlatego działa jako szlachetna powłoka.
Problem tego rodzaju powłoki polega na tym, że po pęknięciu będzie promować i dodatkowo przyspieszyć utlenianie metalu poniżej; W tym przypadku cynk jest skorodowany nawet bardziej niż pokrycie magnezem.
I wreszcie, istnieją inne powłoki, które składają się z obrazów, tworzyw sztucznych, przeciwutleniaczy, tłuszczów, żywic itp.
Eksperyment dzieci
Żelazna płyta w miedzianych sole
Prosty eksperyment można opracować z tej samej tabeli indeksów anodowych. Rozpuszczenie rozsądnej ilości (mniej niż 10 gramów) CUSO4· 5H2Lub w wodzie dziecko proszone jest o zanurzenie na wypolerowanej żelaznej płycie. Zdjęcie jest zrobione, a proces może się rozwijać przez kilka tygodni.
Rozpuszczenie jest początkowo niebieskawe, ale zacznie tracić zabarwienie, podczas gdy żelazna płyta nabiera miedzianego koloru. Jest tak, ponieważ miedź jest szlachetna niż żelazo, a zatem jego kation2+ Zostaną one zredukowane do metalicznej miedzi z jonów przypisanych przez utlenianie żelaza:
Fe => wiara2+ + 2e-
Cu2+ + 2e- => Cu
Czyszczenie tlenku srebra
Srebrne obiekty z czasem czaruje, zwłaszcza jeśli mają kontakt ze źródłem związków siarki. Jego tlenek można usunąć, jeśli obiekt jest zanurzony w wannie wodnej z wodorowęglanem sodu i folią aluminiową. Wodorowęglan zapewnia elektrolity, które ułatwi transport elektronów między obiektem a aluminium.
W rezultacie dziecko może docenić, że obiekt traci czarne plamy i będzie świecić swoim charakterystycznym srebrnym kolorem; Podczas gdy folia aluminiowa będzie działać do zniknięcia.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2019). Korozja galwaniczna. Źródło: w:.Wikipedia.org
- Stephen Lower. (16 czerwca 2019). Korozja elektochemiczna. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Otwarty uniwersytet. (2018). 2.4 Proces korozji: korozja galwaniczna. Odzyskane z: otwarte.Edu
- Brush Brush Brush Brush Brush. (S.F.). Przewodnik po korozji galwanicznej. Materiały zaprojektowane przez szczotkę.
- Giorgio Carbonci. (1998). Eksperymenty w elektochemii. Źródło: Fensci.com
- « Sofistyczne pochodzenie relatywizmu, cechy, przykłady
- Cykliczna struktura węglowodorów, właściwości, przykłady »

