Struktura chlorku żelaza (iii), właściwości, uzyskiwanie, zastosowania
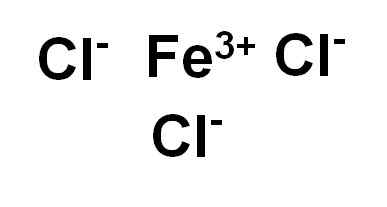
- 1347
- 103
- Estera Wojtkowiak
On chlorek żelaza (iii) Jest to związek nieorganiczny utworzony przez żelazo (wiara) i pierwiastki chloru (CL). Jego wzór chemiczny to FECL3. Jest krystaliczną substancją stałą, której kolor może być od pomarańczowego do czarnego brązu.
FECL3 Łatwo się rozpuszcza w wodzie tworząc kwaśne roztwory wodne, w których zwiększając pH, czyniąc je bardziej alkaliczną.
 Chlorek żelaza (III) lub feCl chlorku żelazowego3 solidny. Еор осин/cc by-sa (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
Chlorek żelaza (III) lub feCl chlorku żelazowego3 solidny. Еор осин/cc by-sa (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. Chlorek żelaza (III) służy do osadu cząstek, które zanieczyszczają ścieki miejskie lub przemysłowe. Mówi się, że pozwala usunąć niektóre pasożyty i służyć do powstrzymania strat krwi od zwierząt na zwierzętach i ich gojenie.
Służy do wydobywania miedzi (II) minerałów siarczkowych miedzi. Jest również stosowany w różnych reakcjach chemicznych i analizie laboratoriów biologicznych i chemicznych. Na przykład służy do wykrywania związków jako fenoli w olejkach ekstrahowanych z roślin. Jest stosowany w obwodach elektronicznych, w skórzanym paleniu i w fotografii.
Za bycie FECL3 Związek kwasowy jest żrący dla błon skóry i śluzowych. Należy unikać pyłu tego związku. Nie należy go odrzucić do środowiska.
[TOC]
Struktura
Chlorek żelaza (III) lub feCl chlorku żelazowego3 Jest to związek jonowy i jest tworzony przez wiarę żelazową3+ i trzy jony chlorek Cl-. Żelazo jest w stanie utleniania +3, a każdy chlor ma walencję -1.
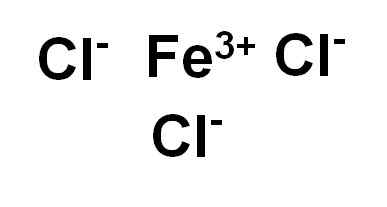 Chlorek żelaza (III) lub chlorek żelazowy. Autor: Marilú Stea.
Chlorek żelaza (III) lub chlorek żelazowy. Autor: Marilú Stea. Nomenklatura
- Chlorek żelaza (iii)
- Chlorek żelaza
- Żelazny trichlorek
- Żelazna muriature
Nieruchomości
Stan fizyczny
Krystaliczny stały pomarańczowy do czarnego brązu.
 FECL chlorku żelazowego3 bezwodne (bez wody). Leiem/cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
FECL chlorku żelazowego3 bezwodne (bez wody). Leiem/cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. Waga molekularna
Anhidro fecl3 = 162,2 g/mol
Temperatura topnienia
Anhidro fecl3 = 304 ° C
Heksahydrat fecl3 •6h2O = 37 ° C
Punkt wrzenia
Anhidro fecl3 = Około 316 ° C
Heksahydrat fecl3 •6h2O = 280-285 ° C
Gęstość
Anhidro fecl3 = 2,90 g/cm3 w 25 ° C
Rozpuszczalność
Bardzo rozpuszczalny w wodzie: 74,4 g/100 g wody w 0 ° C; 535,7 g/100 g wody w 100 ° C. Bardzo rozpuszczalny w acetonie, etanolu, eterze i metanolu. Słabnie rozpuszczalne w rozpuszczalnikach innych niż benzen i heksan.
Może ci służyć: bor: historia, właściwości, struktura, użyciaPh
Jego wodne roztwory są bardzo kwaśne. Roztwór 0,1 mole FECL3 na litr wody ma pH 2,0.
Właściwości chemiczne
Kiedy FADL rozpuszcza się w wodzie3 Jest hydrolizowany; to znaczy, oddziela jony wiary3+ i 3 Cl-. Wiara3+ uformuj jon hexaacuohierro [wiara (h (h2ALBO)6]3+ Ale jest to połączone z jonami OH- wody tworzących mieszane gatunki i uwalniające protony h+.
Z tego powodu ich rozwiązania są kwaśne. Jeśli pH rośnie, gatunki te tworzą żel i wreszcie powstaje osad lub substancja stała uwodnionej wiary tlenku żelaza2ALBO3 •NH2ALBO.
Kryształy chlorkowe żelaza (III) są higroskopijne, to znaczy pochłaniają wodę ze środowiska. Kiedy jest mokry, jest to żrący dla aluminium i wielu metali.
 Rozwiązania FECL3 Mogą być bardzo kwaśne i żrące, ponieważ zawierają HCL. Kanesskong/cc by-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
Rozwiązania FECL3 Mogą być bardzo kwaśne i żrące, ponieważ zawierają HCL. Kanesskong/cc by-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. FECL Wodne roztwory3 Są bardzo kwaśne i żrące dla większości metali. Mają słaby zapach kwasu hydrochlorowego HCl. Gdy FECL jest podgrzewany aż do jego rozkładu3 emituje wysoce toksyczne gazy HCl.
Uzyskanie
Chlorek żelaza (III) jest wytwarzany przez bezpośrednie chlorowanie żelaza przez reakcję suchego chloru (CL2) Z żelaznym złomem (wiara) w 500-700 ° C.
Reakcja przeprowadza się w reaktorze opornym na kwas. Pierwszym krokiem jest stopienie w 600 ° C mieszaninę chlorku żelaza (III) (FECL3) i chlorek potasu (KCl).
 FECL3 Należy go przygotować w pojemnikach bardzo odpornych na kwasy, takie jak stal nierdzewna. Autor: Johannes Plenio. Źródło: Pixabay.
FECL3 Należy go przygotować w pojemnikach bardzo odpornych na kwasy, takie jak stal nierdzewna. Autor: Johannes Plenio. Źródło: Pixabay. Następnie żelazny złom (wiara) rozpuszcza się w tej stopionej mieszaninie, w której żelazo reaguje z FECL3 I staje się chlorkiem żelaza (FECL2).
Fe + 2 Fecl3 → 3 FECL2
Następnie Fecl2 reaguje z chlorem CL2 tworząc FECL3 które sublimaty (przechodzi od stanu stałego do gazu bezpośrednio) i jest zbierany w specjalnych komórkach kondensacyjnych.
2 Fecl2 + Cl2 → 2 FECL3
Możesz także reakcja feso feso siarczan feso4 z chlorem CL2.
Heksahydrat fecl3 •6h2O Można go uzyskać przez odparowanie wodnego roztworu jonów wiary3+ i Cl- W kąpieli parowej.
Może ci służyć: związki czwartorzędowe: cechy, szkolenie, przykładyObecność w naturze
Chlorek żelazowy lub chlorek żelaza (III) występuje w postaci w postaci minerału MO -mineralnego, który występuje w lawie aktywnych fumaroli wulkanów. Wśród wulkanów, w których można znaleźć, jest Mount Vesubio.
 FECL3 Jest częścią rudy moysite, która jest w aktywnych wulkanach. Autor: Skeze. Źródło: Pixabay.
FECL3 Jest częścią rudy moysite, która jest w aktywnych wulkanach. Autor: Skeze. Źródło: Pixabay. Aplikacje
W oczyszczaniu ścieków
Chlorek żelazowy jest stosowany do leczenia ścieków komunalnych lub przemysłowych poprzez sedymentację chemiczną.
Działa jako koagulant sprzyjający zjednoczeniu kilku cząstek ze sobą, w ten sposób tworzą się konglomeraty lub większe cząstki, które mają tendencję do flokułowego lub osadu (obniżając własny ciężar na dnie obróbki wody).
 FECL3 Służy do oddzielenia niepożądanych materiałów od wód odrzuconych przez społeczności lub branże. Autor: 后园 卓. Źródło: Pixabay.
FECL3 Służy do oddzielenia niepożądanych materiałów od wód odrzuconych przez społeczności lub branże. Autor: 后园 卓. Źródło: Pixabay. W ten sposób faworyzuje się oddzielenie stałych wodnych i jest to wolne od niechcianych materiałów.
Ten rodzaj leczenia może ułatwić usunięcie pasożytów, takich jak pierwotniaki, które są mikroorganizmami utworzonymi przez pojedynczą komórkę, taką jak amibas, które powodują chorobę.
Z tego powodu FECL3 Służy również do oczyszczania wody.
W procedurach leczenia weterynaryjnego
Chlorek żelaza (III) służy do leczenia urazów zwierząt.
Służy jako lokalny ściągający (można cofać tkanki i działać jako anty -zaprzestanie i gojenie) i hemostatyczne (zatrzymuje krwawienie lub utratę krwi).
Jest stosowany w proszkach do powstrzymania strat krwi lub gdy konie zostały przecięte na bydło. Jest również stosowany w roztworze, aby zatrzymać krwawienie, gdy pazury są cięte lub brodawki eliminowane.
 FECL3 Jest stosowany w proszkach stosowanych do krów wyciętych rogów i unika infekcji. Autor: Jaclou dl. Źródło: Pixabay.
FECL3 Jest stosowany w proszkach stosowanych do krów wyciętych rogów i unika infekcji. Autor: Jaclou dl. Źródło: Pixabay. Jest również stosowany w leczeniu zapalenia gardła (zapalenie gardła) lub zapalenia jamy ustnej (zapalenie błony śluzowej jamy ustnej) i do zwiększenia hemoglobiny krwi u niektórych ptaków.
W ekstrakcji metalu
Chlorek żelaza (III) lub feCl chlorku żelazowego3 Służy do ekstrakcji miedzi (II) rudy miedzi zawierającej siarczki wspomnianego metalu.
Może ci służyć: wodorotlenkiJest to metoda oksydacyjna, która jest odpowiednia, aby uniknąć uwalniania toksycznego dwutlenku siarki gazowej (więc2), ponieważ zamiast tego jest generowane siarki (s). Produkowane są roztwory o wysokich stężeniach FECL2, Fecl3, Cucl2 i inne metalowe chlorki.
4 Fecl3 + Cu2S ⇔ 4 fecl2 + 2 Cucl2 + S ↓
Jako odczynnik laboratoriów chemicznych i biologicznych
Wśród wielu zastosowań chemii służy wskazaniu obecności grupy fenolowej (to znaczy grupy -OH przymocowanej do pierścienia benzenowego).
Związek jest rozpuszczany w celu analizy w etanolu i dodano kilka kropli roztworu FECL3. Gdy związek ma grupę -OH przymocowaną do pierścienia benzenowego (to znaczy jest fenol), powstaje niebieskawe zielone zabarwienie.
Ten test pozwala przeanalizować obecność fenoli w ekstraktach roślin.
 FECL3 W obecności fenoli daje niebieskawe zielone zabarwienie. Autor: Ewa Urban. Źródło: Pixabay.
FECL3 W obecności fenoli daje niebieskawe zielone zabarwienie. Autor: Ewa Urban. Źródło: Pixabay. Jest również stosowany w testach do określenia aktywności przeciwutleniającej niektórych olejków wydobytych z warzyw.
Kolejnym z jego zastosowań jest to, że pozwala przygotować inne związki chemiczne. Może również działać jako utleniający, chlorujący środek (dostarczanie chloru) i skraplacza (w celu połączenia ze sobą dwóch lub więcej cząsteczek).
Służy również jako katalizator lub akcelerator reakcji chemii organicznej.
W kilku aplikacjach
Chlorek żelazowy jest używany w drukowanych obwodach elektronicznych. Przez zabarwienie różnych nawilżonych form służy jako pigment i jest używany w skórzanym opalacz.
 FECL3 Jest używany w skórzanej opalaniu. Autor: Pexels. Źródło: Pixabay.
FECL3 Jest używany w skórzanej opalaniu. Autor: Pexels. Źródło: Pixabay. Jest dezynfekujący. Jest stosowany w leczeniu zaburzeń skóry i jest również stosowany w fotografii.
Ryzyko
Proszek fecl3 To irytujące dla oczu, nosa i ust. Jeśli wdychanie może powodować kaszel lub trudności z oddychaniem. Jest to związek żrący, więc przedłużony kontakt ze skórą i oczami lub błonami śluzowymi może powodować zaczerwienienie i oparzenia.
Nie jest łatwopalne, ale po ogrzewaniu w wysokich temperaturach wytwarza gaz chlorku wodoru HCl, który jest toksyczny i bardzo żrący.
FECL3 Jest szkodliwy dla organizmów wodnych i lądowych. Jeśli przez przypadek zostanie odrzucony do środowiska, jego kwasowość z podstawowymi związkami musi zostać zneutralizowana.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Chlorek żelaza. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Tom 19. Czwarta edycja. John Wiley & Sons.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). PIĄTA EDYCJA. Tom A22. VCH Verlagsgellschaft MBH.
- Ngameni, ur. i in. (2013). Flawonoidy i powiązane związki z roślin leczniczych Afryki. Charakterystyka flawonoidów w ekstraktach roślinnych. Test chlorku żelaza. W badaniach roślin leczniczych w Afryce. Odzyskane z naukowym.com.
- Agyare, c. i in. (2017). Petroselinum crispum: recenzja. Aktywność antyoksydacyjna. W spartenach leczniczych i warzywach z Afryki. Odzyskane z naukowym.com.
- Stott, r. (2003). Los i zachowanie pasożytów w systemach oczyszczania ścieków. Sedymentacja wspomagana chemicznie. W podręczniku mikrobiologii wody i ścieków. Odzyskane z naukowym.com.
- Tasker, str.DO. i in. (2003). Zastosowania chemii koordynacji. Ekstrakcja CuIi Z roztworów chlorkowych. W zrozumieniu chemii koordynacji. Odzyskane z naukowym.com.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- « +125 Krótkie i popularne powiedzenia [ze znaczeniem]
- 95 powiedzeń i powiedział Wenezuelczycy i ich znaczenie »

