Charakterystyka cytotrofoblastów, rozwój i funkcja
- 880
- 140
- Pani Waleria Marek
On Cytotrofoblast o Komórki Langhans, jest to część błony podstawnej trofoblastu złożonego z mononuklowanych komórek. Ta część odpowiada populacji komórek macierzystych, z której pochodzą inne trofoblasty.
Ta warstwa komórkowa z mitotycznego punktu widzenia jest bardzo aktywna, wytwarzając komórki, które wiążą się z syncytiotrofoblastem. Cytotrofoblast pochodzi z okresu implantacji blastocysty w embrionalnym rozwoju ssaków. Podczas tej fazy rozwoju komórki trofoblastyczne proliferacji ustępują miejsca inwazji na nabłonku endometrium.
 Źródło: Henry Vandyke Carter [domena publiczna]
Źródło: Henry Vandyke Carter [domena publiczna] [TOC]
Charakterystyka
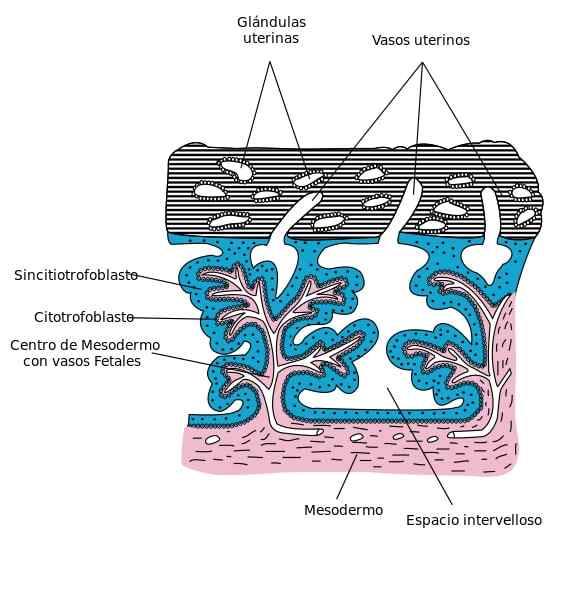
Warstwa mononuklowanych komórek tworzy cytotrofoblast, po wewnętrznej stronie trofoblastu. Komórki te znajdują się w kosmkach kosmówek i są objęte syncytotrofoblastem. Cytotrofoblast charakteryzuje się wysoką różnicowaniem komórek i zdolnością proliferacji oraz niską aktywnością funkcjonalną.
W fazie lub oknie implantacji zarodka komórki cytotrofoblastów pochodzą, stając się sześcienne i blade z dobrym obrazem nuklearnym.
Proliferacja komórek cytotrofoblastycznych występuje przez ciągłe mnożenie komórek. Szacuje się, że co najmniej połowa komórek w tej warstwie wykonuje cykl komórkowy. Oprócz proliferacji istnieje wysokie zróżnicowanie komórek, które generuje syntiotrofoblast.
Ekstrawelllozytarian cytofoblast
Ekramowanie cytofoblastu znajduje się zewnętrznie na kosmkach kosmówek. Ta warstwa komórkowa szybko proliferuje atak zrębu macicy i spiralne tętnice endometrium, zmniejszając odporność ścian naczyniowych. Zróżnicowane są dwa rodzaje cytofoblastów ekstrahitoniarnych: śródmiąższowy i wewnątrznaczyniowy.
W śródmiąższu komórki atakują myometrium, aby połączyć się i stać się dużymi komórkami łożyska. Te komórki nie atakują ścian naczyniowych.
Może ci służyć: pachyneZ drugiej strony wewnątrznaczyniowe, atakują ściany naczyniowe niszczące gładkie komórki środkowej warstwy naczynia krwi. Dyfuzja cząsteczek symulujących fenotyp śródbłonka pozwala zastąpić śródbłonek matczynych naczyń krwionośnych nową powierzchnią wewnętrzną.
Aktywność cytotrofoblastów jest regulowana przez czynniki genetyczne, transkrypcyjne, wzrost, hormonalne i chemiczne (takie jak stężenie tlenu cząsteczkowego).
Rozwój i funkcja
U ssaków, po zapłodnieniu zalania przez nasienie, seria podziałów komórkowych przeprowadzana jest do momentu powstania blastocysty, która jest pustą kuli komórkowej, w której warstwa komórek obwodowych powoduje powstanie trofoblast tkanki zarodkowe, nazywające zarodek.
Blastocyst jest ustalany do endometrium podczas wdrażania. Komórki trofoblastyczne zaczynają rozprzestrzeniać się, gdy wchodzą w kontakt z endometrium, w ten sposób różnicując cytotrofoblast i syncytiotrofoblast.
W gatunku ludzkim wdrożenie odbywa się w przybliżeniu do szóstego dnia po owulacji i zapłodnienia owula.
U niektórych ssaków faza ta jest przełożona na dni, tygodnie, a nawet miesiące, aby uniknąć przybycia nowej rasy w niekogennym momencie, jak w okresach, w których zasoby zmniejszają się lub podczas gdy matka karmi kolejną hodowlę.
U zwierząt takich jak niedźwiedzie, woli, pieczęci i wielbłądów występuje opóźnienie okna implantacyjnego znane jako embrionalna diapauza.
Blastocyst pozostaje w tym stanie, bez proliferacji komórek cytotrofoblastycznych, przez działanie hormonalne. Mechanizm ten jest wyzwalany w odpowiedzi na czynniki środowiskowe lub przedłużone karmienie piersią u matki.
Może ci służyć: czym są chromoplast?Formacja łożyska
Łożysko jest odpowiedzialne za utrzymanie płodu w rozwoju i wywodzi się z kosmówki (część płodowa) i podstawy liściaste. W nim występuje wymiana gazów i metabolitów między obiegami matczynymi i płodowymi. Ten organ rozwija się, pochodząc z różnicowych kosmków.
Gdy komórki cytotrofoblastów oraz wraz z rozwojem krezki naczyniowej i naczyń krwionośnych powiększają.
Cytotrofoblast szybko się proliferuje, przechodząc komórki do laguny krwi wewnątrz syncytiotrofoblastu, tworząc pierwotne kosmki kosmówkowe.
Następnie te kosmki są atakowane przez embrionalny mezenchym kosmów, który pozostaje w środku i otoczony cytotrofoblastem, tworzą.
Miejsce trzeciorzędowe powstają wraz z pojawieniem się naczyń krwionośnych w mezenchymie wtórnych kosmków.
Podczas gdy trzeciorzędowe kosmki, gwinty lub kielich komórkowe cytotrofoblastu powstają na zewnątrz przez syncytotroplast.
W ten sposób różne aglomeraty komórkowe wyjeżdżają za granicę i łączą się, obejmując syncytotrofoblast z osłoną cytotrofoblastyczną. Ta pokrywa jest przerywana tam, gdzie matczyne naczynia krwionośne przechodzą do pomieszczeń między.
Interfejs matki-i-fetal
Pierwszy etap interfejsu matczyno-płodowego składa się z inwazji cytofoblastu z ekstrawezjnego (zlokalizowanego poza kosmami łożyska) w tętnicach spiralnych macicy, nadając tym tętnice cechy bycia wysokim kaliberem i mającą odporność na przepływ. W ten sposób utrzymuje się odpowiednia perfuzja wzrostu płodu.
W drugiej fazie komórki cytotrofoblastów łączą się, cofając błony komórkowe, aby zwiększyć wielojądrową warstwę syncytotrofoblastu. Ten ostatni obejmuje zróżnicowane kosmki łożyska.
Może ci służyć: Hepar Will Siulfate: Funkcje, synteza, związek z chorobamiWłaściwy rozwój tych dwóch etapów interfejsu, zapewnia prawidłowe miejsce, a zatem udany rozwój płodu i bezpieczny postęp stanu grawitacji.
Bariera łożyska oddziela krew matki i płodu
Bariera łożyska, zasadniczo utworzona przez warstwy tkanki płodowej, jest odpowiedzialna za oddzielenie krwi od płodu krwi matki. U ludzi, z czwartego miesiąca rozwoju, bariera ta staje się bardzo cienka, ułatwiając przenoszenie produktów przez nią.
Zgodnie degeneracji powłoki lub pokrywy cytotrofoblastycznej jest przyczyną utraty masy bariery łożyskowej, w której stanie degenerowanym składa się z syncytiotrofoplastu, podstawowego endothelium i endothelium i endothelium i endothelium Kapilary łożyska płodowe kosmków trzeciorzędowych.
Bariera łożyska, oprócz oddzielenia krwi od krwi i krwi płodowej, jest odpowiedzialna za wymianę tlenu i dwutlenek węgla i metabolity między obiegami matczynymi i płodowymi.
Bibliografia
- Hernández-Valencial, m., Valencia-Ortega, J., Ríos-Castillo, ur., Cruz-Cruz, s. 1. D. R., & Vélez-Sánchez, D. (2014). Elementy implantacji i łożyska: aspekty kliniczne i metalowe. Meksykański magazyn medycyny reprodukcji, 6 (2), 102-16.
- Hill, r. W., Wyse, g. DO., Anderson, m., & Anderson, m. (2004). Zwierzę z fizjologii (Tom. 2). Sunderland, MA: Sinauer Associates.
- Kardong, k. V. (1995). Kręgowce: anatomia porównawcza, funkcja, ewolucja. Wyd. McGraw Hill.
- Rodríguez, m., Couve, c., Egaña, g., & PSIMY, v. (2011). Apoptoza łożyska: mechanizmy molekularne w genezie przedprzestrzeni. Chilijskie położnictwo i magazyn Ginekologii, 76 (6), 431-438.
- Ross, m. H., & Pawlina, w. (2007). Histologia. Wyd. Pan -american Medical.
- Welsch, u., & Sobotta, j. (2008). Histologia. Wyd. Pan -american Medical.
- « Charakterystyka syncytotrofoplastu, funkcja, apoptoza łożyska
- Charakterystyka basofilów, morfologia, funkcje, choroby »

