Citocroma C Struktura oksydazy, funkcje, inhibitory
- 4096
- 607
- Herbert Wróblewski
Citocroma C oksydaza Jest to enzymatyczny kompleks białka, który może przekraczać dwuwarstwę lipidową błony komórkowej. Jest to głównie związane z wewnętrzną błoną mitochondriów, zarówno w organizmach prokariotycznych (bakterie), jak u eukariotów (jednokomórkowe i wielokomórkowe).
Nazywany również kompleks IV, ten enzym jest niezbędny w aerobowych funkcjach metabolicznych organizmów, ponieważ jest niezbędny w łańcuchu transportu elektronów, w którym komórka spala cukry i przechwytuje część energii uwolnionej do przechowywania tryfosforanu adenozyny lub ATP.
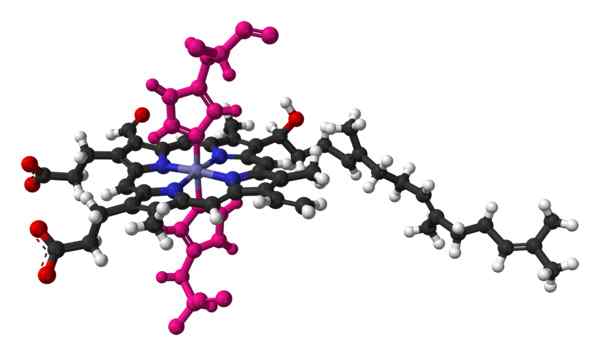
 Model bola i Palo hemo, cząsteczki stwierdzonej w krystalicznej strukturze cytochromu C oksydazy serca bydlęcej. Zrobione i zredagowane z: Benjah-BMM27 [domena publiczna].
Model bola i Palo hemo, cząsteczki stwierdzonej w krystalicznej strukturze cytochromu C oksydazy serca bydlęcej. Zrobione i zredagowane z: Benjah-BMM27 [domena publiczna]. Nazwa cytochromu oznacza „pigmenty komórkowe”. Są to białka krwi, które transportują elektrony. Cytochromy zostały odkryte przez irlandzkiego lekarza Charlesa Alexandra Macmunna w 1884 roku. MacMunn był pionierem w odkrywaniu pigmentu oddechowego krwi, zwanego dziś cytochromem 1.
W latach 20. ubiegłego wieku rosyjski entomolog i pasożyta. Chociaż MacMunn odkrył je w 1884 roku, społeczność naukowa zapomniała i nawet niektórzy źle zrozumiał.
[TOC]
Ogólne cechy
Zasadniczo pigmenty oddechowe mają charakterystyczne widma widzialne. Wiadomo, że istnieją co najmniej cztery kompleksowe kompleksy białkowe błony, w których występuje 5 różnych rodzajów cytochromów: A, A3, B, C1 i C, sklasyfikowane według długości fali maksimum absorpcji spektralnej.
Zwykle występują w wewnętrznej błonie mitochondriów. Jednak obserwowano je również w retikulum endoplazmatycznym i chloroplastom, w organizmach eukariotycznych i prokariotycznych.
Prezentują grupę protetyczną hemo zawierającą żelazo (wiara). Każdy z znanych cytochromów działa w kompleksach multienzimatycznych w transporcie elektronów łańcucha oddechowego.
Cytochromy mają funkcję uczestnictwa w reakcjach redukcji tlenku. Reakcje redukcji, w których akceptują elektrony, występują inaczej dla każdego rodzaju cytochromu, a ich wartość zależy od przepływu elektronów łańcucha oddechowego.
-Cytochrom c
Znane są cztery rodzaje cytochromu C, które są następujące.
Klasa I
W tej klasie znajdują się rozpuszczalne cytochromy C niskiego zakrętu (lowowspin), obecne w bakteriach i mitochondriach. Są oktaedralami. Miejsce Hemo Union znajduje się na końcu histydyny, a szósty ligand jest dostarczany przez resztę metioninową na końcu C.
Z tej klasy możesz nawet rozpoznać kilka podklas, które zostały ustalone ich trójwymiarową strukturę.
Klasa II
W tej klasie znajdują się cytokromy C o wysokim zakręcie (highspin) i trochę niskiego obrotu. Wysoki zwrot jest miejscem wiązania w pobliżu końca-C, a u osób z niskim skrętem szósty ligand wydaje się być resztą metioninową w pobliżu końca N-Termus w języku angielskim). Są one Pinakoordynowane z piątą ligandem histydyną.
Może ci służyć: turgiczność (biologia)Klasa III
Ta klasa charakteryzuje się cytochromami C z wieloma HEMO (C3 i C7) i niskim potencjalnym reduktorem tlenku, z zaledwie 30 resztami aminokwasów na hemo. U przedstawicieli tej klasy grupy hemo C mają strukturę i funkcje nierównoważne, oprócz prezentacji różnych potencjałów redoks. Są oktaedralami.
Klasa IV
Według niektórych autorów klasa ta została stworzona tylko po to, aby obejmować złożone białka prezentowane między innymi przez inne grupy protetyczne, a także hemo c lub flawocytokrome C.
Cytochrom oksydaza C lub kompleks IV
Cytochromowa oksydaza C jest enzymem mitochondrialnym, który przeprowadza końcową fazę transportu elektronicznego w oddychaniu komórkowym. Ten enzym katalizuje transport elektronów z zmniejszonego cytochromu C do tlenu.
Niektóre związki chemiczne, takie jak cyjanek, dwutlenek węgla i azid. Innymi formami hamowania kompleksu IV są mutacje genetyczne.
Z ewolucyjnego punktu widzenia oksydaza cytochromu C występuje tylko w organizmach aerobowych, a kilka grup naukowców sugeruje, że obecność tego białka wskazuje na relacje ewolucyjne, w których rośliny, grzyby i zwierzęta również dzieliły przodka wspólnego wspólnego.
Struktura
Cytochromowa oksydaza C tworzy kompleks homodimeryczny, to znaczy z dwóch podobnych monomerów w błonie wewnętrznej mitochondriów. Kompleks enzymatyczny składa się z 3 do 4 podjednostek w organizmach prokariotycznych i maksymalnie 13 (niektóre sugerują 14) polipeptydów w organizmach takich jak ssaki.
W tych organizmach 3 polipeptydy mają pochodzenie mitochondrialne, a reszta pochodzą z jądra. Każdy monomer ma 28 śmigieł transbłonowych, które oddzielają domeny hydrofilowe od matrycy błony i przestrzeni międzybłonowej.
Ma tylko jedną jednostkę katalityczną, która występuje we wszystkich enzymach, które katalizują reakcje utleniania/redukcji, przy użyciu tlenu cząsteczkowego (oksydazy, zwłaszcza hemo-cobre). Kompleks zawiera cytochromy A i A3 zjednoczone przez podjednostki I i dwa centra miedzi.
Przedstawia jedną lub kilka grup hemo c powiązanych z otaczającą strukturą białka przez jedno lub więcej (ogólnie dwa) łącza tyiolutowe. Inni autorzy sugerują, że istnieje pojedyncza grupa hemo C połączona z białkiem między pierścieniem porfirynowym a dwoma resztami cysteiny.
Jedyna wspomniana powyżej grupa hemo C jest otoczona odpadami hyodrofobicznymi i jest heksakoordynowana, ponieważ jest histydyna w pozycji 18 łańcucha polipeptydowego i metodę w 80.
Może ci służyć: komórka roślinna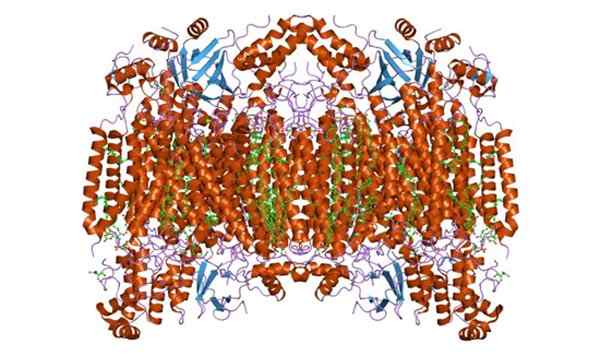 Podjednostka oksydazy cytochromu C. Zrobione i zredagowane z: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna]
Podjednostka oksydazy cytochromu C. Zrobione i zredagowane z: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna] Funkcje
Citocroma C oksydazy są bohaterami w trzech pierwotnych mechanizmach fizjologicznych, które zobaczymy poniżej.
Apoptoza lub zaprogramowana śmierć komórki
Apoptoza to zniszczenie lub zaprogramowana śmierć komórki, spowodowana tym samym organizmem i ma na celu kontrolowanie wzrostu, rozwoju, eliminacji uszkodzonych tkanek i regulacji układu odpornościowego. W tym procesie fizjologicznym oksydaza cytochromu C uczestniczy jako pośrednik.
Białko to uwalniane przez mitochondria, prowadzi do interakcji z retikulum endoplazmatycznym, co powoduje wydzielanie lub uwalnianie wapnia. Postępujący wzrost wapnia wyzwala masowe uwalnianie oksydazy cytochromu C, aż możliwe jest osiągnięcie poziomów cytotoksycznych wapnia.
Cytotoksyczne poziomy wapnia i uwalnianie cytochromów C powodują aktywację kaskadowych kilku enzymów, które są odpowiedzialne za zniszczenie komórek.
Regeneracja komórki lub tkanki
Kilka badań wskazuje, że gdy oksydaza cytochromu C jest narażona na długości fali 670 nanometrów, uczestniczy w kompleksie funkcjonalnym, który penetruje uszkodzoną lub uszkodzoną tkankę i zwiększa prędkość regeneracji komórek.
Metabolizm energetyczny
Jest to być może najbardziej znany i najbardziej odpowiednia funkcja oksydazy cytochromu C. Właśnie kompleks oksydazy (łańcucha oddechowego) odpowiedzialny za zbieranie elektronów cytochromu C i przenosi je do cząsteczki tlenu, zmniejszając ją do dwóch cząsteczek wody.
Połączone z tym procesem, istnieje translokacja protonów przez membranę, co powoduje generowanie gradientu elektrochemicznego, którego kompleks syntezazy ATP stosuje do wytwarzania lub syntezy ATP (adenosín triffisphyte).
Inhibitory
Citocroma C oksydaza jest hamowana przez kilka procesów i związków chemicznych. Sposób, w jaki występuje, może powstać jako naturalny sposób regulacji produkcji lub działania enzymu lub może wystąpić przypadkowo z powodu zatrucia.
W obecności azid. Powoduje to przerwę w komórkowym procesie oddechowym, a zatem powoduje chemiczne uduszenie komórek.
Inne związki, takie jak tlenek azotu, siarkowodór, metanol i niektóre metylowane alkohole, również powodują hamowanie oksydazy cytochromu C.
Niedobór
Cytochromowa oksydaza C jest enzymem kontrolowanym przez geny zarówno jądra, jak i mitochondriów. Istnieją zmiany genetyczne lub mutacje, które mogą mieć niedobór oksydazy cytochromu C.
Mutacje te zakłócają funkcjonalność enzymu, ponieważ zmieniają swoją strukturę enzymatyczną, przynosząc ze sobą zaburzenia metaboliczne podczas rozwoju embrionalnego (według badań u ludzi), co później wpłynie na organizm w pierwszych latach życia.
Może ci służyć: komórki dendrytyczne: cechy, funkcja, typyNiedobór oksydazy cytochromu C wpływa na tkanki o wysokim zapotrzebowaniu na energię, takie jak serce, wątroba, mózg i mięśnie. Objawy tych mutacji są odzwierciedlone przed dwoma latami życia i mogą objawiać się jako silne lub łagodne warunki.
Łagodne objawy można zobaczyć nawet wkrótce po pierwszym roku i zwykle osoby z nimi mają jedynie spadek napięcia mięśni (hipotonia) i atrofia mięśni (miopatia).
Z drugiej strony osoby, które mają silniejsze objawy, mogą mieć zanik mięśni i encefaliopatię. Innymi warunkami spowodowanymi brakiem oksydazy cytochromu C są przerostowa mięśnia sercowa, patologiczny wzrost wielkości wątroby, zespół Leight i kwasicy mleczan.
Zastosowania w filogenezie
Filogeneza to nauka odpowiedzialna za badania pochodzenia, szkolenia i rozwoju ewolucyjnego z punktu widzenia przodka, organizmów. W ostatnich dziesięcioleciach badania filogenetyczne z analizą molekularną coraz częściej występują, rzucając wiele informacji i rozwiązując problemy taksonomiczne.
W tym sensie niektóre badania filogenetyczne wskazują, że zastosowanie oksydaz cytochromu C może pomóc w ustaleniu relacji ewolucyjnych. Wynika to z faktu, że ten kompleks białkowy jest wysoce zachowany i jest obecny w wielu różnych organizmach, od protistów jednokomórkowych, po duże kręgowce.
Przykładem tego są testy wykonane z ludźmi, szympansami (Chleb) i Resus Macaques (Mulatta Macaca). Takie testy wykazały, że cząsteczki oksydazy cytochromu C ludzi i szympansów były identyczne.
Wykazał również, że cząsteczki oksydazy cytochromu C makaku rezus.
Bibliografia
- R.P. Ambler (1991). Zmienność sekwencji w cyrkromach bakteryjnych C. Biochimica et Biophysica Acta (BBA) - Bioenergetyka.
- Cytochrom c. Odzyskany z Newworldyclopedia.org.
- V.Colman, e. Koszt. Chaves, v. Tortora (2015). Biologiczne role cytochromu C: mitochondrialny transport elektroniczny, zaprogramowaną śmierć komórek i wzrost aktywności AUS. Annals of the Faculty of Medicine.
- Podjednostka oksydazy cytochromu C. Odzyskane z EBI.AC.Wielka Brytania.
- L. YOUFEN, s. Jeong-Ono, zm. Jian-Hong i B. Yidong (2007). Podjednostka oksydazy cytochromu C jest niezbędna do montażu i funkcji oddechowej kompleksu enzymatycznego. Journal of Bioenergetics and Biomembranes.
- Grupa genów: kompleks IV mitochondrialny: podjednostki oksydazy cytochromu C (Cox, MT-CO). Odzyskane z Genenames.org.
- I.F. Hartree (1973). Odkrycie cytochromu. Edukacja biochemiczna.
- Citocroma C oksydaza, niedobór .. . Odzyskane z Ivami.com.
- C.K. Mathews, k.I. Van Hold & K.G. Ahern (2002). Biochemery. 3. edycja. Benjamin / Cummings Publishing Company, Inc.
- « Charakterystyka opotillo, siedlisko, właściwości i szkodniki
- Charakterystyka Pinus patula, siedlisko, taksonomia, zastosowania, szkodniki »

