Kwas selenowy (H2SE) Co to jest, struktura, właściwości, używa
- 3728
- 294
- Pani Gilbert Stolarczyk
 Seleniuro wodoru: dwie cząsteczki wodoru i jeden z selenu
Seleniuro wodoru: dwie cząsteczki wodoru i jeden z selenu Co to jest kwas selenowy?
On Kwas selenowy o wodór seleniuro jest nieorganicznym związkiem, którego wzorem chemicznym wynosi h2ON. Ma charakter kowalencyjny, aw zwykłych warunkach temperatury i ciśnienia jest to gaz bezbarwny; Ale z silnym rozpoznawalnym zapachem jego niewielkiej obecności. Chemicznie jest to przecięcie, więc selen ma walencję -2 (i2-).
Ze wszystkich seleniurów, h2Jest najbardziej toksyczny, ponieważ jej cząsteczka jest niewielka, a jej atom selenu ma mniej przeszkody steryczne podczas reagowania. Z drugiej strony jego zapach pozwala tym, którzy z nim pracują, wykryć go w akcie w przypadku zewnętrznego dzwonka laboratoryjnego.
Wodór seleniuro może syntetyzować przez bezpośrednią kombinację jego dwóch pierwiastków: wodór molekularny, H2, i metaliczny selen. Można go również uzyskać przez rozpuszczające się związki bogate w selen, takie jak seleniuro żelaza (II), FESE, w kwasie solnym.
Z drugiej strony kwas selenowy jest przygotowywany przez rozpuszczenie wodoru seleniuro w wodzie; Oznacza to, że pierwszy jest rozpuszczony w wodzie, a drugi składa się z napojów bezalkoholowych.
Jego głównym zastosowaniem jest bycie źródłem selenu w syntezie organicznej i nieorganicznej.
Struktura seleniuro wodoru
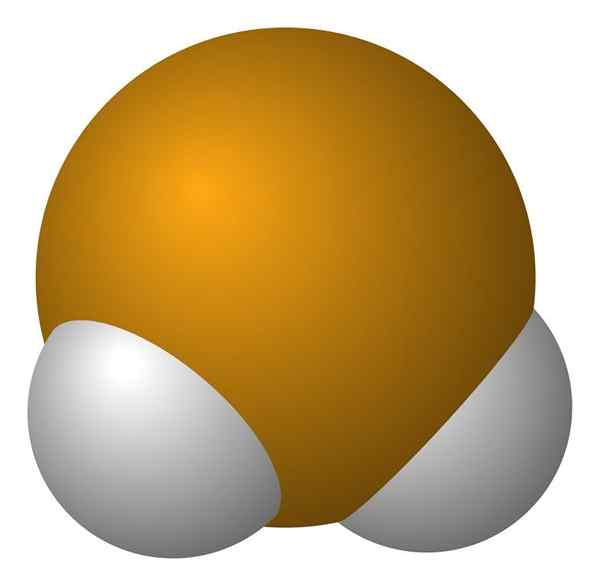
 Cząsteczka seleniuro wodoru. Wikimedia Commons.
Cząsteczka seleniuro wodoru. Wikimedia Commons. Molekula H2Ma geometrię kątową, chociaż jego kąt 91 ° sprawia, że wygląda bardziej jak L niż do v. W tym modelu sfer i prętów atomy wodoru i selen to odpowiednio białe i żółte kule.
Ta cząsteczka, jak pokazano, jest tą, która znajduje się w fazie gazowej; to znaczy w przypadku wodoru seleniuro. Podczas rozpuszczania się w wodzie uwalnia proton i w roztworze masz parę HSE- H3ALBO+; Ten moment obrotowy jonowej przychodzi do kwasu selenhydowego, oznaczonego jako H2SE (AC) w celu odróżnienia go od seleniuro wodoru, H2SE (g).
Może ci służyć: niebieski metylen: charakterystyka, przygotowanie, zastosowania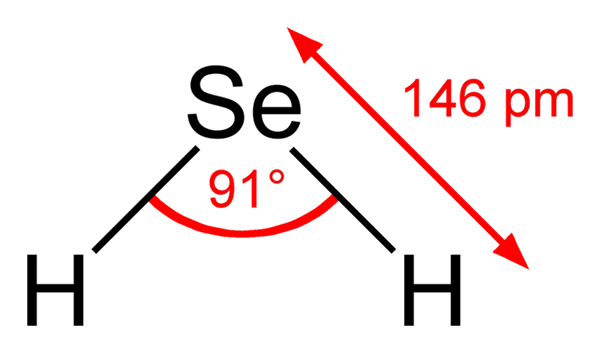 Strukturalny formuła kwasu seleenhydralnego. Ben Mills, Wikimedia Commons ..
Strukturalny formuła kwasu seleenhydralnego. Ben Mills, Wikimedia Commons .. Dlatego struktury między h2SE (AC) i H2SE (g) są bardzo różne; Pierwszy jest otoczony wodną kulą i ma obciążenia jonowe, a drugi składa się z aglomeratu cząsteczek fazy gazowej.
Cząsteczki H2Ledwo mogą ze sobą wchodzić w interakcje przez bardzo słabe siły Dipolo-Dipolo. Selen, chociaż jest mniej elektroonywalny niż siarka koncentruje większą gęstość elektroniczną, aby „wyrwać” z atomów wodoru.
Selenio Hydrues skompresowany
Jeśli cząsteczki h2Udostępniają niezwykłą presję (setki GPA), teoretycznie są zmuszeni do zestalenia poprzez tworzenie linków SE-H; Są to linki trzech centrów i dwóch elektronów (3C-2E), w których uczestniczy wodór. Dlatego cząsteczki zaczynają tworzyć struktury polimerowe, które definiują ciało stałe.
W tych warunkach stałe z większym wodorem można wzbogacić, co całkowicie modyfikuje powstałe struktury. Ponadto kompozycja staje się typu HNSE, gdzie n waha się od 3 do 6. Zatem wodorki selenu ściskane przez te ciśnienia, aw obecności wodoru mają wzory chemiczne H3Wiem h6ON.
Szacuje się, że te hydrory selenu wzbogacone wodorem mają właściwości nadprzewodnicze.
Nieruchomości
Wygląd fizyczny
Bezbarwny gaz, który w niskich temperaturach pachnie jak putrefacto i zgniłe jaja, jeśli jego stężenie wzrośnie. Jego zapach jest gorszy i intensywny niż siarkowodór (który jest już dość nieprzyjemny). Jest to jednak dobre, ponieważ pomaga w łatwym wykryciu i zmniejsza przedłużone ryzyko kontaktu lub inhalacji.
Kiedy się pali, wydziela niebieskawy iloczyn interakcji elektronicznych w atomach selenu.
Może ci służyć: tlenek siarkiMasa cząsteczkowa
80,98 g/mol.
Punkt wrzenia
-41 ° C.
Temperatura topnienia
-66 ° C.
Ciśnienie pary
9,5 atm w 21 ° C.
Gęstość
3553 g/l.
PkDo
3.89.
Rozpuszczalność wody
0,70 g/100 ml. To potwierdza fakt, że atom selenu H2Nie można tworzyć mostów wodorowych znaczących cząsteczek wody.
Rozpuszczalność w innych rozpuszczalnikach
-Rozpuszczalne w Cs2, co nie jest zaskakujące chemiczną analogią między selenem a siarką.
-Phosgen rozpuszczalny (w niskich temperaturach, ponieważ gotuje się w 8 ° C).
Nomenklatura
Jak wyjaśniono w poprzednich sekcjach, nazwa tego związku różni się w zależności od tego, czy H2Jest w sodzie lub rozpuszczonej fazie w wodzie. Kiedy jest w wodzie, mówi się o kwasu seleenhydropu, który jest niczym więcej niż hydraystą w kategoriach nieorganicznych. W przeciwieństwie do cząsteczek gazowych, jego kwaśny charakter jest większy.
Jednak jako gaz lub rozpuszczony w wodzie atom selenu utrzymuje te same cechy elektroniczne; Na przykład jej walencja wynosi -2, chyba że poniesie reakcję utleniania. Ta Walencja -2 jest powodem, dla którego nazywa się ją seleniżubr wodoru, ponieważ anion seleniuro jest2-; który jest bardziej reaktywny i redukcyjny niż S2-, siarczek.
Jeśli zastosowana jest systematyczna nomenklatura, należy określić liczbę atomów wodoru w związku. Tak więc h2Nazywa się: Seleniuro of dałwodór.
Seleniuro lub wodorot?
Niektóre źródła nazywają go wodorkiem. Gdyby tak było, selen miałby ładunek dodatni +2, a obciążenie ujemne wodoru -1: SEH2 (ON2+, H-). Selen jest bardziej elektroonegatywnym atomem niż wodór, a zatem kończy „monopolizując” najwyższą gęstość elektroniczną w cząsteczce H2ON.
Może ci służyć: termochemiaJednak jako takie istnienie wodorku selenu nie można odrzucić. W rzeczywistości z obecnością hionów H- Ułatwiłoby to łącza SE-H, odpowiedzialne za struktury solidne utworzone na ogromne naciski według badań komputerowych.
Aplikacje
Metaboliczny
Chociaż wydaje się to sprzeczne, pomimo wielkiej toksyczności H2SE, jest wytwarzany w ciele na metabolicznej trasie selenu. Jednak komórki są ledwo wytwarzane jako pośrednik w Synitium selenioprotein lub kończą się metylowane i wydalane; Jednym z objawów jest smak czosnku w ustach.
Przemysłowcy
H2Służy głównie do dodawania atomów selenu do struktur stałych, takich jak materiały półprzewodników; do cząsteczek organicznych, takich jak alkeny i nitryle do syntezy seleniurów organicznych; lub do roztworu w celu wytrącania metalicznych seleniurów.
Bibliografia
- Selenid wodoru. Źródło: w:.Wikipedia.org
- Selenid wodoru, H2ON. Odzyskane z: selen.Atomia.com

