Kwas panie, co jest, struktura, synteza, właściwości
- 3125
- 973
- Gabriela Łuczak
On Kwas panie Jest to wysoce nitrado organiczny związek chemiczny, którego nazwa IUPAC to 2,4,6-trinitrofenol. Jego wzór molekularny to C6H2(NIE2)3Oh. Jest to bardzo kwaśny fenol i można go znaleźć jako pikrat sodu, amon lub potas; to znaczy w formie jonowej c6H2(NIE2)3NA.
Jest to solidny silny smak gorzki i odtąd czerpie swoją nazwę od greckiego słowa „prikos”, co oznacza gorzki. Występuje jako mokre żółte kryształy. Jego wysuszenie lub odwodnienie są niebezpieczne, ponieważ zwiększa niestabilne właściwości, które sprawiają, że jest wybuchowy.
Kwas panie jest stosowany jako podstawa syntezy stałych barwników żółtego. Niektórzy patolodzy i badacze używają go w fiksacji lub barwieniu odcinków tkanek i innych procesów immunohistochemicznych.
Jest to bardzo przydatne w rozwoju produktów farmaceutycznych. Ponadto jest używany w opracowaniu meczów lub meczów i materiałów wybuchowych. Służy również do rejestrowania metali, do robienia kolorowego szkła, a w kolorymetrycznym określeniu parametrów biologicznych, takich jak kreatynina.
Struktura
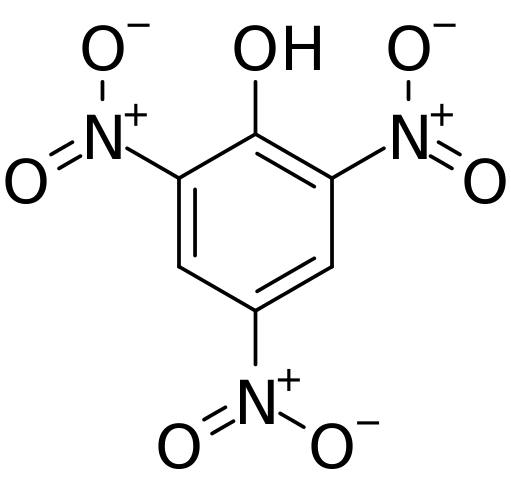
 Struktura i formalne obciążenia kwasu pychorowego. Źródło: CVF-PS [domena publiczna]
Struktura i formalne obciążenia kwasu pychorowego. Źródło: CVF-PS [domena publiczna] Na górnym obrazie wszystkie wiązania i struktura sama w sobie cząsteczki kwasu panie są pokazane bardziej szczegółowo. Składa się z fenolu z trzema podstawnikami nitro.
Widać, że w grupach nie2 Atom azotu ma dodatnie obciążenie częściowe, a zatem zapotrzebowanie na gęstość elektroniczną z otoczenia. Ale pierścień aromatyczny przyciąga również elektrony do siebie, a przed trzema nie2 ostatecznie daje część własnej gęstości elektronicznej.
W wyniku tego tlen grupy OH bardziej dzieli jednego ze swoich wolnych elektronicznych rówieśników w celu dostarczenia niedoboru elektronicznego poniesionego przez pierścień; W ten sposób powstaje link c = o+-H. To dodatnie częściowe obciążenie tlenu osłabia wiązanie O-H, a kwasowość wzrasta; to znaczy zostanie uwolniony jako jon wodoru, h+.
Kwas fenol
Z tego powodu ten związek jest wyjątkowo silnym kwasem (i odczynnikiem), nawet bardziej niż sam kwas octowy. Jednak związek jest tak naprawdę fenolą, której kwasowość przekracza kwasę innych fenoli; Zgodnie z tym, jak już wspomniano, podstawieni nie2.
Może ci służyć: procesy termodynamiczneDlatego, ponieważ jest to fenol, grupa OH ma pierwszeństwo i kieruje wyliczeniem w strukturze. Trzy nie2 Znajdują się w węgle 2, 4 i 6 pierścienia aromatycznego w odniesieniu do OH. Stąd wyprowadza nomenklaturę IUPAC dla tego związku: 2,4,6-trinitrofenol (TNP).
Gdyby grupy nie były2, Lub gdyby na pierścieniu była ich mniejsza, łącznik O-H mniejszy byłby, a zatem związek miałby mniejszą kwasowość.
Struktura krystaliczna
Cząsteczki kwasu pikrynowego są uporządkowane w taki sposób, że faworyzują swoje interakcje międzycząsteczkowe; albo do tworzenia mostów wodorowych między grupami OH i nie2, Siły Dipolo-Dipolo lub odpychanie elektrostatyczne między słabymi obszarami elektronów.
Można się spodziewać, że grupy nie2 Odstraszają i wskazują w kierunku sąsiednich aromatycznych pierścieni. Podobnie pierścienie nie mogły wyrównać jednego na siebie ze względu na wzrost odpychania elektrostatycznego.
W wyniku wszystkich tych interakcji, kwas Píchric udaje się utworzyć sieć trójwymiarową, która definiuje kryształ; którego jednolita komórka odpowiada krystalicznego układu typu ortorrombicznego.
Synteza
Początkowo został zsyntetyzowany z naturalnych związków, takich jak pochodne rogu zwierząt, żywice naturalne, między innymi. Od 1841 r.
Jak już powiedziano, jest to jeden z najbardziej kwaśnych fenoli. Aby go zsyntetyzować, najpierw wymaga się, aby fenol doznał procesu sulfonacji, a następnie procedury nitrowania.
Sulfonowanie bezwodnego fenolu przeprowadza się podczas leczenia fenolu za pomocą kwasu siarkowego dymu, występujące aromatyczne podstawy elektrofiliczne H przez grupy sulfonianowe, więc3H, w pozycji -orto i -para w odniesieniu do grupy OH.
Ten produkt, kwas 2,4-pinoldysulfonowy, proces nitracji jest przeprowadzany, lecząc go skoncentrowanym kwasem azotowym. W ten sposób dwie grupy3H są zastępowane przez grupy nitro, nie2, A trzecia wchodzi do drugiej pozycji Nitro. Poniższe równanie chemiczne to ilustruje:
Może ci służyć: elastyczne materiały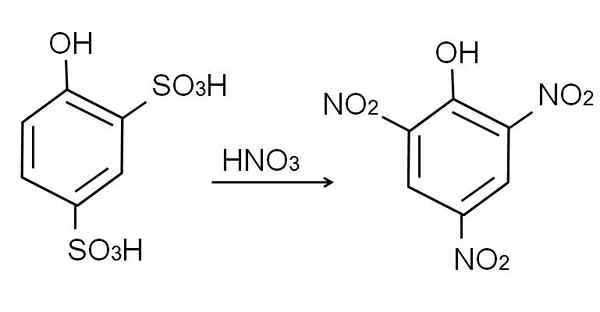 Azotracja kwasu 2,4-fenoldysulfonowa. Źródło: Gabriel Bolívar.
Azotracja kwasu 2,4-fenoldysulfonowa. Źródło: Gabriel Bolívar. Bezpośrednie nitrytacja fenolu
Proces nitracyjny fenolu nie może być przeprowadzany bezpośrednio, ponieważ generowane są cele o wysokiej masie cząsteczkowej. Ta metoda syntezy wymaga bardzo starannej kontroli temperatury, ponieważ jest bardzo egzotermiczna:
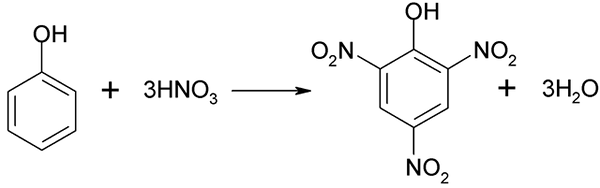 Bezpośrednie nitrytacja fenolu. Źródło: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Bezpośrednie nitrytacja fenolu. Źródło: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Kwas panie można uzyskać podczas wykonywania bezpośredniego procesu nitrowania 2,4-dinitrofenolu, z kwasem azotowym.
Inną formą syntezy jest leczenie benzenu kwasem azotowym i azotanem rtęciowym.
Fizyczne i chemiczne właściwości
Waga molekularna
229.104 g/mol.
Wygląd fizyczny
Żółta masa mokrych kryształów.
Zapach
To jest toaleta.
Smak
Jest bardzo gorzki.
Temperatura topnienia
122.5 ° C.
Punkt wrzenia
300 ° C. Ale podczas topnienia eksploduje.
Gęstość
1,77 g/ml.
Rozpuszczalność
Jest to umiarkowanie rozpuszczalny w wodzie związek. To dlatego, że twoje grupy OH i nie2 Mogą oddziaływać z cząsteczkami wody przez mosty wodorowe; Chociaż pierścień aromatyczny jest hydrofobowy i dlatego szkodzi jego rozpuszczalności.
Korozja
Kwas pykryrowy jest ogólnie żrący w przypadku metali, z wyjątkiem cyny i aluminium.
PKA
0,38. Jest to silny kwas organiczny.
Niestabilność
Kwas panie charakteryzuje się posiadaniem niestabilnych właściwości. Stanowi ryzyko dla środowiska, jest niestabilne, wybuchowe i toksyczne.
Musi być przechowywany dobrze zamknięty, aby uniknąć odwodnienia, ponieważ kwas pikralny jest bardzo wybuchowy, jeśli może się wysuszyć. Musisz być bardzo ostrożny z jego bezwodnym kształtem, ponieważ jest bardzo wrażliwy na tarcia, ciosy i ciepło.
Kwas pychralny powinien być przechowywany w wentylowanych, świeżych miejscach, z daleka od materiałów oksydacyjnych. Jest to drażniące kontakt ze skórą i błonami śluzowymi, nie należy go połknąć i jest toksyczny dla organizmu.
Aplikacje
Kwas panie jest szeroko stosowany w obszarze badań, w chemii, w przemyśle i w dziedzinie wojskowej.
Dochodzenie
Zastosowanie jako utrwalacza komórka i tkanki, poprawia ich wyniki kolorów za pomocą barwników kwasowych. Dzieje się tak z metodami barwienia trichromowego. Po ustawieniu tkaniny z forminą zaleca się nowe fiksacja z kwasem panienowym.
Może ci służyć: filtr prasowy: Charakterystyka, części, jak działa, używaW ten sposób gwarantowane jest intensywne i bardzo jasne zabarwienie tkanek. Dobre wyniki uzyskuje się za pomocą podstawowych barwników. Jednak środki ostrożności muszą.
Chemia organiczna
-W chemii organicznej jest stosowany jako pikrat alkaliczny do identyfikacji i analizy różnych substancji.
-Jest stosowany w chemii analitycznej metalowej.
-W laboratoriach klinicznych jest stosowany do określania surowicy i poziomu kreatyniny w moczu.
-Zastosowano go również w niektórych odczynnikach zastosowanych do analizy poziomów glukozy.
W przemyśle
-Na poziomie branży fotograficznej kwas pmienkowy był używany jako wrażliwy w emulsjach fotograficznych. Był częścią opracowania produktów takich jak pestycydy, silne środki owadobójcze, między innymi.
-Kwas panie jest stosowany do syntezy innych pośrednich związków chemicznych, takich jak na przykład chloropikryna i kwas pikramowy. Z tych związków opracowano niektóre leki i barwniki dla przemysłu skórzanego.
-Kwas panie zastosowano w leczeniu oparzeń, takich jak warunki antyseptyczne i inne, zanim udowodniono jego toksyczność.
-Ważny komponent według wybuchowego charakteru w opracowaniu meczów i akumulatorów.
Aplikacje wojskowe
-Z powodu wysokiej wybuchowości kwasu panienowego, był on używany w roślinach amunicji broni wojskowej.
-Zastosowano kwas phichrałowy i odlewany w pociskach artyleryjskich, pomp i kopalniach.
-Sól amonowa kwasu pikrynowego została wykorzystana jako wybuchowy, jest bardzo silna, ale mniejsza stabilność niż TNT. Przez pewien czas był używany jako komponent paliwa rakietowego.
Toksyczność
Udowodniono, że jest bardzo toksyczny dla ludzkiego organizmu i ogólnie dla wszystkich żywych istot.
Zaleca się unikanie jego wdychania i spożycia, aby mieć ostrą toksyczność doustną. Powoduje także mutację w mikroorganizmach. Przedstawia toksyczne działanie na dziką przyrodę, u ssaków i ogólnie w środowisku.
Bibliografia
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Purdue University. (2004). Eksplozja kwasu pikolowego. Źródło: chemed.Chem.Purdue.Edu

