Kwas fosforowy (H3PO4)
- 1836
- 556
- Pani Gilbert Stolarczyk
 Indywidualna cząsteczka kwasu fosforowego
Indywidualna cząsteczka kwasu fosforowego Co to jest kwas fosforowy?
On Kwas fosforowy Jest to kwas okso fosforu, który ma wzór chemiczny H3PO4. Składa się z kwasu mineralnego, w którym trzy protony kwasu są powiązane z anionem fosforanowym (PO43-). Chociaż nie jest uważane za silny kwas, jego niewłaściwe użycie może mieć zagrożenie dla zdrowia.
Można go znaleźć w dwóch stanach: jako stał w postaci grubych kryształów ortorombowych lub jako krystaliczny płynny syrop. Jego najbardziej zwykła prezentacja komercyjna ma stężenie 85% P/P i gęstość 1685 g/cm3. Ta gęstość pochodzi z ręki koncentracji.
Trzy grupy OH są odpowiedzialne za przekazanie hydrogenów kwasowych. Ze względu na ich obecność w ich strukturze możesz reagować z różnymi wodorotlenkami powodującymi kilka soli.
W przypadku wodorotlenku sodu możesz utworzyć trzy: monobazowy fosforan sodu (Nah2PO4), Dibasowy fosforan sodu (na2HPO4) i trybazowy fosforan sodu (na3PO4).
Jednak w zależności od tego, która podstawa jest wykorzystywana do neutralizacji lub jakie kationy są bardzo bliskie, możesz tworzyć inne sole fosforanowe. Wśród nich są: fosforan wapnia (CA3(PO4)2), Fosforan litowy (Li3PO4), fosforan żelazowy (Fepo4), i inni. Każdy z różnym stopniem protonowania anionu fosforanowego.
Z drugiej strony, kwas fosforowy może „porwać” kationów zróżnicowanych, takich jak wiara2+, Cu2+, AC2+ i Mg2+. W wysokich temperaturach możesz zareagować ze sobą z utratą cząsteczki H2Lub tworzące średnice, trymer i polimery kwasów fosforowych.
Ten rodzaj reakcji sprawia, że ten związek zdolny do ustanowienia dużej liczby struktur z fosforami i szkieletami tlenu, z których można również uzyskać szeroki zakres znanych soli, takich jak polifosforany.
Jeśli chodzi o jego odkrycie, został zsyntetyzowany w 1694 roku przez Roberta Boyle'a (1627-1691), rozpuszczając P2ALBO5 (Pentlenek fosforu) w wodzie. Jest to jeden z najbardziej przydatnych kwasów mineralnych, który jest najważniejszą funkcją nawozu.
Fosfor, potas i azot stanowią trzy główne składniki odżywcze roślin.
Chemiczna struktura kwasu fosforowego
 Chemiczna struktura kwasu fosforowego
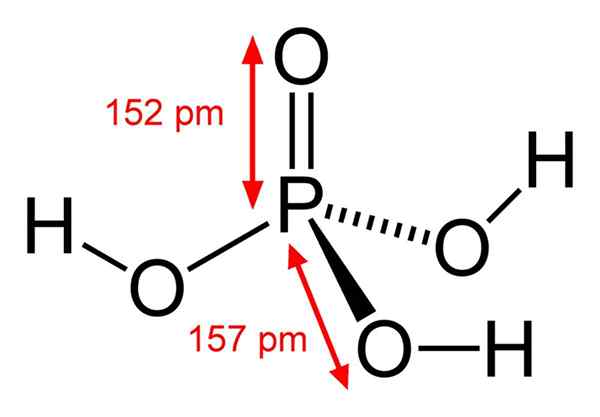
Chemiczna struktura kwasu fosforowego Kwas fosforowy składa się z wiązania p = o. Z atomem fosforu w środku tlen narysuje rodzaj molekularnego tetrahedanu.
W ten sposób kwas fosforowy można wizualizować jako tetrahedron. Z tej perspektywy te tetrahedry (przez jednostki H3PO4) oddziaływać ze sobą przez mosty wodorowe; to znaczy ich wierzchołki zbliżają się.
Te interakcje międzycząsteczkowe umożliwiają krystaliczne kwas fosforowy w dwóch stałach: bezwodnych i hemihydrat (H (H (H. H3PO4· 1/2h2O), oba z monoklinicznymi układami krystalicznymi. Jego formularz anhydra można również opisać wraz z wzorem: 3H2Lub · p2ALBO5, który jest równy tri-hydracanemu pentoksykowi fosforu.
Tetrahedra może nawet łączyć się kowalencyjnie, ale dla tej jednej z jej jednostek musi wyeliminować cząsteczkę wody poprzez odwodnienie. Dzieje się tak, gdy h3PO4 Używa ogrzewania i generuje w konsekwencji tworzenie kwasów polifosferycznych (PA).
Kwas dyposforowy (h4P2ALBO7)
Najprostszym ze wszystkich PA jest kwas diposforowy (h4P2ALBO7), znany również jako kwas pirofosforowy. Równanie chemiczne twoich formacji jest następujące:
Może ci służyć: fosforan glinowy (ALPO4): struktura, właściwości, uzyskiwanie, zastosowania2h3PO4 H4P2ALBO7 + H2ALBO
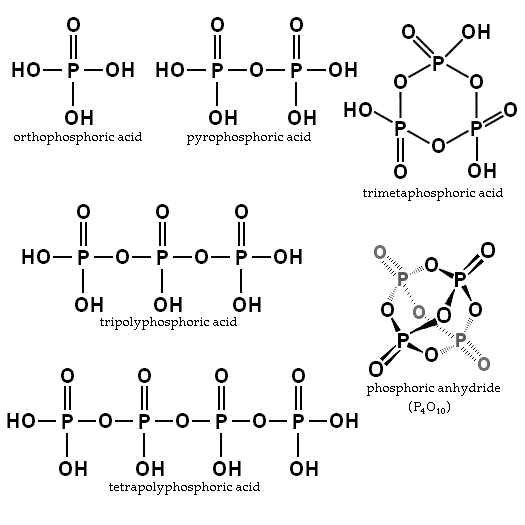
Równowaga zależy od ilości wody i temperatury. Jaka jest jego struktura? Na obrazie odcinka struktury kwasu ortofosfoshowego i pirofosforowego zilustrowano w lewym górnym rogu.
Dwie jednostki łączą kowalencyjnie, gdy cząsteczka wody jest wyeliminowana, tworząc między nimi most tlenu P-O-P. Teraz nie są to trzy kwasowe wodór, ale cztery (cztery grupy -OH). Z tego powodu h4P2ALBO7 przedstawia cztery stałe kDo.
Kwasy polifosforowe
Odwodnienie może kontynuować kwas pirofosforowy, jeśli ogrzewanie trwa. Ponieważ? Ponieważ na każdym końcu jej cząsteczki istnieje grupa OH, którą można wyeliminować jako cząsteczkę wody, promując w ten sposób późniejszy wzrost szkieletu p-O-O-O-p ... p ..
Przykładami tych kwasów są kwasy trimfosforowe i tetropoliforowe (oba również zilustrowane na poprzednim zdjęciu). Można zobaczyć, jak szkielet P-O-P wydłuża się w łańcuchu utworzonym przez tetrahedry.
Związki te mogą być reprezentowane z formułem HO (PO2OH)XH, gdzie Ho jest lewym końcem, który może odwodnić. PO2Och, jest szkieletem fosforu z łączami P = O i OH; I x są jednostkami kwasu fosforowego lub cząsteczkami niezbędnymi do uzyskania wspomnianego łańcucha.
Gdy te związki są całkowicie zneutralizowane, powstają polifosforany SO. W zależności od tego, które kationów są otoczone, tworzą szeroką gamę soli polifosforanowych.
Z drugiej strony, jeśli reagują z alkoholami ROH, hydrogeny ich szkieletu są zastępowane przez podstawniki alkilowe r-. Zatem pojawiają się estry fosforanowe (lub polifyse): ro (PO2Lub)XR. Wystarczy zastąpić H wszystkimi strukturami obrazu sekcji, aby.
Cykliczne kwasy polifosforowe
Łańcuchy P-O-P można nawet zamknąć w pierścieniu lub cyklu fosforowym. Najprostszym tego rodzaju związku jest kwas trimetafosforyczny (prawy górny róg obrazu). Zatem PA mogą być liniowe, cykliczne; lub jeśli ich struktury wykazują oba typy, rozgałęzione.
Nomenklatura
 Kwas fosforowy. Źródło: Commons.Wikimedia.org
Kwas fosforowy. Źródło: Commons.Wikimedia.org Nomenklatura kwasu fosforowego rządzi IUPAC i sposób, w jaki nazywane są sole zerowe oksoacidów.
Ponieważ w h3PO4 Atom P ma walencję +5, ten o największej wartości, jego kwas przypisuje się sufiks -ico do prefiksu fosforowego-.
Ortho-
Jednak kwas fosforowy jest również powszechnie opowiadany kwas ortofosforowy. Ponieważ? Ponieważ słowo „orto” jest greckie i oznacza „prawdziwe”; co spowodowałoby „prawdziwą formę” lub „bardziej uwodnione” tego samego.
Gdy fosforowe anhydro jest uwodnione nadmiarem wody (str4ALBO10, „Superior Image„ Cap ”)3PO4 (3h2Lub · p2ALBO5). Zatem prefiks Ortho jest przyznawany tym kwasom utworzonym z obfitą wodą.
Piro-
Prefiks PIRO odnosi się do każdego związku pochodzi po zastosowaniu ciepła, ponieważ kwas diposforowy powstaje z termicznego odwodnienia kwasu fosforowego. Jest zatem nazywany kwasem pirofosforowym (2h2Lub · p2ALBO5).
Bramka-
Prefiks docelowy, który jest również słowem greckim, oznacza „po”. Jest dodawany do tych substancji, których wzór wyeliminował cząsteczkę, w tym przypadku, wody:
H3PO4 => HPO3 + H2ALBO
Należy zauważyć, że tym razem dodanie dwóch jednostek fosforowych nie występuje w celu utworzenia kwasu diposforowego, ale zamiast kwasu metafosforowego (z którego nie ma dowodów na jego istnienie).
Może ci służyć: alkohol etylowy: struktura, właściwości, zastosowania, uzyskiwanieNależy również podkreślić, że ten kwas można opisać jako H2Lub · p2ALBO5 (Podobnie do hemidratu, mnożąc HPO3 Dla 2). Prefiks meta- jest idealnie zgodnie z cyklicznym PA, ponieważ jeśli kwas trfosforowy zostanie odwodniony, ale nie dodaje kolejnej jednostki H3PO4 Aby stać się kwasem tetrafosforowym, musisz uformować pierścień.
I to jest to samo z innymi kwasami polimeetofosforowymi, chociaż IUPAC zaleca nazywanie ich jako cyklicznymi związkami odpowiedniego PA.
Właściwości kwasu fosforowego
Formuła molekularna
H3PO4
Waga molekularna
97 994 g/mol
Wygląd fizyczny
W swojej stałej postaci przedstawia kryształy ortorombowe, higroskopijne i przezroczyste. W postaci cieczy jest krystaliczny, z lepkim wyglądem syropu.
W handlu osiąga się w roztworze wodnym o stężeniu 85% P/P. We wszystkich tych prezentacjach nie ma zapachu.
Punkty wrzenia i fuzji
158º C (316º F A 760 mmHg).
108º F (42,2º C).
Rozpuszczalność wody
548 g/100 g H2Lub 20º C; 369,4 g/100 ml w 0,5º C; 446 g/100m przy 14,95º C.
Gęstość
1 892 g/cm3 (solidny); 1 841 g/cm3 (100%rozwiązanie); 1685 g/cm3 (85%rozwiązania); 1334 g/cm3 50%rozwiązanie) w 25ºC.
Gęstość pary
Względne powietrze 3.4 (powietrze = 1).
Immon
To nie jest łatwopalne.
Breja
3,86 MPOISE (40% do 20º C).
Kwasowość
PH: 1,5 (0,1 N roztwór w wodzie)
PKA: PKA1 = 2148; PKA2 = 7198 i PKA3 = 12 319. Dlatego jego najbardziej kwaśny wodór jest pierwszym.
Rozkład
Kiedy jest ogrzewany, uwalnia tlenki fosforu. Jeśli temperatura wzrośnie do 213º C lub więcej staje się kwasem pirofosforowym (H (H4P2ALBO7).
Korozja
Korozyjne do metali żelaznych i aluminium. Podczas reakcji z tymi metaliami pochodzi gaz palny wodór.
Polimeryzacja
Gwałtownie polimeryza z związkami mistyfikacji, epoksydami i związkami polimeryzowani.
Kwas fosforowy
Fosfat i ogólne wykorzystują sprzedaż
-Kwas fosforowy służy jako podstawa opracowania fosforanu, które są stosowane jako nawozy, ponieważ fosfor jest głównym składnikiem odżywczym roślin.
-Został zastosowany w leczeniu wiodących zatruć i innych warunków, w których wymagane są ważne ilości fosforanu i wytwarzanie łagodnej kwasicy.
-Służy do kontrolowania pH przewodów moczowych norki i kotów w celu uniknięcia tworzenia się obliczeń nerek.
-Kwas fosforowy powoduje sole NA2HPO4 i nie2PO4 które stanowią system amortyzatora pH z PKA 6,8. Ten system regulacyjny pH jest obecny u ludzi, ma znaczenie w regulacji pH wewnątrzkomórkowej, a także w leczeniu stężenia wodoru w dystalnych i kolekcjonerskich kanalikach nefronów.
-Jest stosowany w eliminacji warstwy mohozy tlenku żelaza, która gromadzi się na tym metalu. Kwas fosforowy tworzy fosforan żelaza, który można łatwo usunąć z powierzchni metalowej. Jest również stosowany w aluminium elektrycznym.
Przemysłowcy
-Kwas fosforowy jest przeznaczony jako środek katalityczny w opracowaniu nylonu i benzyny. Jest stosowany jako środek odwadniający w grawerowaniu litograficznym, w opracowaniu barwników do stosowania w przemyśle tekstylnym, w procesie krzepnięcia lateksu w przemyśle brzegowym i o oczyszczaniu nadtlenku wodoru (nadtlenek wodoru (nadtlenek wodoru).
-Kwas jest używany jako dodatek w napojach bezalkoholowych przyczyniających się w ten sposób do swojego smaku. Rozcieńczony, jest stosowany w procesie rafinacji cukru. Działa również jako układ amortyzatora w przygotowaniu szynki, żelatyny i antybiotyków.
Może ci służyć: wodorotlenek aluminiowy: struktura, właściwości, zastosowania, ryzyko-Interweniuje w opracowaniu detergentów, w katalizie kwasowej produkcji acetylenu.
-Jest stosowany jako kwasulant w zrównoważonej żywności dla przemysłu zwierząt gospodarskich i zwierząt domowych. Przemysł farmaceutyczny wykorzystuje go w produkcji leków przeciwwymiotowych. Wykorzystuje również mieszaninę, aby uczynić asfalt, aby utorować ziemię i naprawić pęknięcia.
-Kwas fosforowy działa jak katalizator w reakcji hydratacji alkenów w celu wytworzenia alkoholu, głównie etanolu. Ponadto jest stosowany w określeniu węgla organicznego w glebie.
Dentystyczny
Jest używany przez dentystów do czyszczenia i kondycjonowania powierzchni dentystycznej przed umieszczeniem wsporników dentystycznych. Znajduje się również w wybielaniu dentystycznym i eliminacji płyt dentystycznych. Ponadto jest stosowany w produkcji kleju do protez dentystycznych.
Kosmetyki
Kwas fosforowy służy do dostosowania pH w opracowywaniu produktów kosmetycznych i do pielęgnacji skóry. Jest stosowany jako chemiczny środek utleniający do produkcji węgla aktywnego.
Tworzenie kwasu fosforowego
-Kwas fosforowy jest przygotowywany ze skał fosforanowych typu apatytowego za pomocą stężonego trawienia kwasu siarkowego:
AC3(PO4)2 + 3 godz2południowy zachód4 + 6 godz2O => 2 H3PO4 + 3 (sprawa4.2h2ALBO)
Kwas fosforowy uzyskany w tej reakcji jest niską czystością, więc ulega on procesowi oczyszczania, który obejmuje wytrącanie, ekstrakcję rozpuszczalnika, krystalizację i techniki wymiany jonów.
-Kwas fosforowy może wystąpić przez rozpuszczenie pentoksydu fosforu w wrzącej wodzie.
-Można go również uzyskać przez ogrzewanie fosforu z mieszaniną pary powietrza i wody:
P4 (l) +5 o2 (g) => p4ALBO10 (S)
P4ALBO10 (s) +h2Lub (g) => 4h3PO4 (L)
Ryzyko
-Ponieważ ciśnienie pary jest niskie w temperaturze pokojowej, jest mało prawdopodobne, aby twoje opary były wdychane, chyba że kwas zostanie spryskany. Jeśli tak, objawy ich wdychania obejmują: kaszel, ból gardła, krótkie i pracochłonne oddychanie.
-W literaturze sprawa marynarza, która była narażona na opary kwasu fosforowego przez długi czas. Cierpiało ogólne osłabienie, suchy kaszel, ból w klatce piersiowej i problemy z oddychaniem. Po roku po wystawie zaobserwowano reaktywną dysfunkcję dróg oddechowych.
-Skórny kontakt z kwasem fosforowym może powodować zaczerwienienie, ból, pęcherze i oparzenia skóry.
-Kontakt kwasu z oczami, w zależności od jego stężenia i czasu trwania kontaktu, może wytwarzać w tych, zmian żrących tkanek lub ciężkie oparzenia z trwałym uszkodzeniem oka.
-Spożycie kwasu powoduje oparzenie w jamie ustnej i gardle, uczucie żaroodporne poza mostkiem, ból brzucha, wymioty, wstrząs i zapadnięcie się.
Bibliografia
- Royal Society of Chemistry. (2015). Kwas fosforowy. Zaczerpnięte z: Chemspider.com
- Kanadyjskie centrum zdrowia i bezpieczeństwa zawodowego. (1999). Kwas fosforowy - skutki zdrowotne. Zaczerpnięte z: CCSSO.AC
- Kwasy.Informacje. (2018). Kwas fosforowy „różnorodność zastosowań tego związku chemicznego. Zaczerpnięte z: kwasów.Informacje
- James p. Smith, Walter E. Brown i James R. Lehr. (1955). Struktura krystalicznego kwasu fosforowego. J. JESTEM. Chem. Soc. 77, 10, 2728-2730
- Wikipedia. (2018). Kwasy fosforowe i fosforany. Zaczerpnięte z: w.Wikipedia.org
- Nauka jest zabawą. Dowiedz się o kwasie fosforowym. [PDF]. Zaczerpnięte z: Scifun.Chem.Wisc.Edu

