Struktura kwasu chromowego, właściwości, uzyskiwanie, zastosowania

- 3826
- 52
- Filip Augustyn
On kwas chromowy lub h2Cro4 Kwas związany z tlenkiem chromu (VI) lub tlenkiem CRO jest teoretycznie3. Ta denominacja wynika z faktu, że w kwaśnych roztworach wodnych tlenku chromu gatunek H2Cro4 Jest obecny z innymi gatunkami chromu (vi).
Tlenek kromowy3 Nazywa się to również bezwodnym kwasem chromowym. Cro3 Jest to czerwonawe lub fioletowe brązowe ciało, które jest uzyskiwane podczas leczenia roztworów dichromianu potasu k2Cr2ALBO7 Z kwasem siarkowym H2południowy zachód4.
 Zmiażdżki tlenku kromowego3 W tyglu. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikipedia Commons.
Zmiażdżki tlenku kromowego3 W tyglu. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikipedia Commons. Wodne roztwory tlenku chromu doświadczają równowagi niektórych gatunków chemicznych, których stężenie zależy od pH roztworu. Podstawowe pH dominują jony cromate cro42-, Podczas gdy jony kwasu hcro dominują4- i Cr Dicromato2ALBO72-. Szacuje się, że kwas kwaśny występuje również kwas chromowy H2Cro4.
Ze względu na jego wielką moc utleniania roztwory kwasu chromowego stosuje się w chemii organicznej do wykonywania reakcji utleniania. Są również stosowane w procesach elektrochemicznych w leczeniu metali, aby nabierać odporności na korozję i zużycie.
Niektóre materiały polimerowe są również traktowane kwasem chromowym w celu poprawy przyczepności do metali, obrazów i innych substancji.
Roztwory kwasu chromowego są bardzo niebezpieczne zarówno dla ludzi, jak i większości zwierząt i środowiska. Z tego powodu odpady ciekłe lub stałe, w których stosuje się kwas chromowy, w celu wyeliminowania resztek chromu (VI) lub w celu odzyskania wszystkiego obecnego chromu i regeneracji kwasu chromowego w celu ponownego użycia go.
[TOC]
Struktura
Cząsteczka kwasu chromowego h2Cro4 Jest tworzony przez cromato cro ion42- i dwa jony wodoru h+ Zjednoczeni do tego. W jonie chromatu pierwiastek chromowy jest w stanie utleniania +6.
Struktura przestrzenna jonu chromianu jest czworościenna, gdzie chrom znajduje się w środku, a tlen zajmuje cztery wierzchołki czworościanu.
W atomach wodoru kwasu chromowego znajdują się obok tlenu. Z czterech wiązań chromu z atomami tlenu, dwa są podwójne, a dwa są proste, ponieważ mają zjednoczone z nimi hydrogeny.
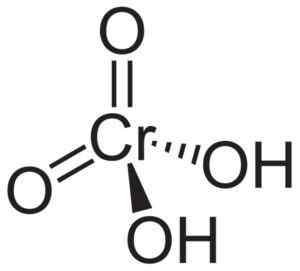 Struktura kwasu chromowego h2Cro4 gdzie obserwuje się czworościenną formę chromianu i jego podwójnych wiązań. Neuropeker [domena publiczna]. Źródło: Wikipedia Commons.
Struktura kwasu chromowego h2Cro4 gdzie obserwuje się czworościenną formę chromianu i jego podwójnych wiązań. Neuropeker [domena publiczna]. Źródło: Wikipedia Commons. Z drugiej strony tlenek cro -croomiczny3 Ma atom chromowy utleniający +6 otoczony tylko trzema atomami tlenu.
Nomenklatura
- Kwas kromowy h2Cro4
- Kwas tetraoksochromowy h2Cro4
- Tlenek kromowy (bezwodny kwas chromowy) cro3
- CRO TRIOROKEK CHROMU (bezwodny kwas chromowy)3
Nieruchomości
Stan fizyczny
Anhydro lub chromowy kwas chromowy jest krystalicznym stałą fioletu do czerwonego
Waga molekularna
Cro3: 118,01 g/mol
Temperatura topnienia
Cro3: 196 ° C
Powyżej jego temperatury topnienia jest niestabilne termicznie, traci tlen (jest zmniejszony), aby podać tlenek chromu (iii) cr2ALBO3. Rozkłada się w około 250 ° C.
Gęstość
Cro3: 1,67-2,82 g/cm3
Rozpuszczalność
Cro3 Jest bardzo rozpuszczalny w wodzie: 169 g/100 g wody w 25 ° C.
Jest rozpuszczalny w kwasach mineralnych, takich jak siarka i azot. Alkohol rozpuszczalny.
Inne właściwości
Cro3 Jest bardzo higroskopowy, jego kryształy są pyszne.
Kiedy cro3 Rozpuszcza się w wodzie, tworzy silnie kwaśne roztwory.
Może ci służyć: tytan: historia, struktura, właściwości, reakcje, zastosowaniaJest to bardzo silny utleniacz. Tlen energicznie organiczna materia w prawie wszystkich jej formach. Atakuje materiał, skórę i trochę tworzyw sztucznych. Większość metali atakuje również.
Jest silnie trujący i bardzo irytujący ze względu na swój duży potencjał utleniający.
Chemia roztworów wodnych, w których występuje kwas chromowy
Tlenek kromowy3 Szybko rozpuszcza się w wodzie. W roztworze wodnym chrom (VI) może istnieć w różnych postaciach jonowych.
PH> 6,5 lub w roztworze alkalicznym Chrome (VI) nabywa formę jonów Cromato42- żółty.
Jeśli pH jest zmniejszone (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , które mogą dimeryzować jon dicromato cr2ALBO72-, A rozwiązanie staje się pomarańczowe. Przy pH od 2,5 do 5,5 dominującymi gatunkami są hcro4- i cr2ALBO72-.
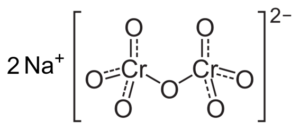 Struktura jonów dicromianu Cr2ALBO72- który jest obok dwóch jonów sodu na+. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikipedia Commons.
Struktura jonów dicromianu Cr2ALBO72- który jest obok dwóch jonów sodu na+. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikipedia Commons. Równowagi, które występują w tych rozwiązaniach, gdy pH spadnie, są następujące:
Cro42- (jon chromaty) + h+ ⇔ Hcro4-
Hcro4- + H+ ⇔ h2Cro4 (kwas chromowy)
2hcro4- ⇔ Cr2ALBO72- (Jon dicromate) + h2ALBO
Równowagi te występują tylko wtedy, gdy kwas dodany do obniżenia pH jest3 lub HCLO4, Ponieważ z innymi kwasami powstają różne związki.
Kwaśne roztwory dichromianu są bardzo energetycznymi środkami utleniającymi. Ale w roztworach alkalicznych jon chromianu jest znacznie mniej utleniający.
Uzyskanie
Według konsultowanych źródeł, jeden ze sposobów uzyskania tlenku cro cromic3, Polega to na dodaniu kwasu siarkowego do wodnego roztworu sodu lub dichromianu potasu, tworząc osad z czerwoną pomarańczową.
 Kwas kromowy lub kwas chromowy. Himstakan [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikipedia Commons.
Kwas kromowy lub kwas chromowy. Himstakan [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikipedia Commons. Kwas kromowy h2Cro4 Występuje w wodnych roztworach tlenku chromu w kwaśnej pożywce.
Kwas chromowy
W utlenianiu związków chemicznych
Ze względu na silną zdolność utleniającą kwas chromowy był stosowany od dłuższego czasu i z powodzeniem utleniania związków organicznych i nieorganicznych.
Wśród niezliczonych przykładów są: umożliwia utlenianie pierwotnych alkoholi na aldehydo i te do kwasów karboksylowych, alkoholi wtórne do ketonów, toluen do kwasu benzoesowego, etylobenzenu do acetofenonu, trifenylogenicznego do trifenylokarbinolu, kwasu o kwasie o benzoos2, kwas szczawiowy do CO2, Kwas mlekowy do acetaldehydu i CO2, Wiara żelazna2+ Wiara wiary żelaza3+, jon jodowy do jodu itp.
Umożliwia konwersję podsumowania azotu na złożony nitro, siarki do sulfonów. Interweniuje w syntezie ketonów na podstawie alkenów, gdy utleniał hydroborowane alken.
Związki bardzo odporne na zwykłe utleniacze, takie jak tlen lub2 lub nadtlenek wodoru H2ALBO2, Są one utleniane przez kwas chromowy. Tak jest w przypadku niektórych heterocyklicznych bastessów.
W procesach anodowania metalu
Anodyzacja kwasu chromowego jest obróbką elektrochemiczną, która dotyczy aluminium w celu ochrony go przez wiele lat przed utlenianiem, korozją i zużyciem.
Proces anodowania obejmuje tworzenie elektrochemiczne warstwy tlenku glinu lub tlenku glinu na metalu. Ta warstwa jest następnie uszczelniana w gorącej wodzie, która osiąga się przez konwersję do trójstronnego tlenku aluminiowego.
Uszczelniona warstwa tlenku jest gruba, ale jest strukturalnie słaba i niezbyt satysfakcjonująca dla kolejnych związków klejących. Jednak dodając niewielką ilość kwasu chromowego do wody uszczelniającej, opracowano powierzchnię, która może tworzyć dobre wiązania.
Może ci służyć: prawo dotyczące ochrony materiiKwas chromowy w wodzie uszczelniającej rozpuszcza część grubej struktury komórek typu i pozostawia cienki, mocny, mocno przymocowany do tlenku aluminium, do którego kleje przyklejają się i tworzą mocne i trwałe stawy.
Anodyzacja kwasem chromowym dotyczy również tytanu i jego stopów.
W trakcie konwersji chemicznej
Kwas chromowy stosuje się w procesach powlekania metali przez konwersję chemiczną.
Podczas tego procesu metale są zanurzone w roztworach kwasu chromu. To reaguje i częściowo rozpuszcza osadzanie powierzchni jednocześnie cienką warstwę złożonych związków chromu, które oddziałują z metalem podstawowym.
Proces ten nazywany jest powłoką konwersji chromatów lub chromem konwersji.
Metale, które są ogólnie poddawane chromowi konwersji, to różne rodzaje stali, takie jak stal węglowa, stal nierdzewna i stal pokryta cynkiem oraz kilka metali nieżeralnych, takich jak stopy magnezu, stopy cyny, stopy aluminium, miedź, kadm, kadm, kadm Mangan i srebro.
To zabieg zapewnia korozję i odporność na jasność na metal. Wyższe pH procesu większa odporność na korozję. Temperatura przyspiesza reakcję kwasową.
Można zastosować powłokę różnych kolorów, takich jak niebieski, czarny, złoty, żółty i przezroczysty. Zapewnia również lepsze przestrzeganie metalowej powierzchni w kierunku obrazów i klejów.
Na erodowanej lub posiekanej powierzchni
Roztwory kwasu chromowego stosuje się w przygotowaniu powierzchni materiału termoplastycznego, termosytowych polimerów i elastomerów do późniejszej powlekania obrazami lub klejem.
H2Cro4 osiąga wpływ na chemię powierzchni i jej strukturę, ponieważ pomaga zwiększyć jego szorstkość. Połączenie ukąszeń i utleniania zwiększa penetrację klejów, a nawet może powodować zmiany właściwości polimeru.
Zastosowano go do erodowania rozgałęzionego polietylenu o niskiej gęstości, wysokiej gęstości i liniowym polipropylenowym polietylenem.
Jest często używany w branży elektro-receipt lub galwanoplastyki, aby ułatwić przyczepność metalowo-polimerową.
W kilku zastosowaniach
Kwas chromowy stosuje się jako drewniany środek konserwujący, również w materiałach magnetycznych i do katalizy reakcji chemicznych.
Odzyskiwanie kwasu kromowego
Istnieje wiele procesów, które wykorzystują kwas chromowy i generują prądy lub reszty zawierające chrom (III), których nie można odrzucić, ponieważ mają one chromowe jony (VI), które są bardzo toksyczne lub ponowne wykorzystanie, ponieważ stężenie jonów chromatu jest bardzo niskie.
Jego dyspozycja wymaga chemicznej redukcji chromatów do chromu (III), a następnie opadów wodorotlenkowych i filtracyjnych, co generuje dodatkowe koszty.
Z tego powodu zbadano różne metody usuwania i odzyskiwania chromatów. Oto niektóre z nich.
Poprzez użycie żywic
Przez wiele lat stosowano żywice wymiany jonowej do oczyszczania wody zanieczyszczonej chromatem. Jest to jedno z zabiegów zatwierdzonych przez amerykańską Agencję Ochrony Środowiska lub EPA (akronim dla angielskiego Agencja Ochrony Środowiska).
Ta metoda umożliwia odzysk stężonego kwasu chromowego, ponieważ jest ponownie regenerowana z żywicy.
Żywice mogą być silną lub słabą bazą. W silnie podstawowych żywicach chromian można usunąć jako jony hcro4- i cr2ALBO72- Są wymieniane z jonami OH- i Cl-. W słabo podstawowych żywicach, na przykład siarczanu, jony są wymieniane z SOS42-.
Może ci służyć: nepelometriaW przypadku silnie podstawowych żywic R- (OH) reakcje globalne są następujące:
2roh + hcro4- + H+ ⇔ r2Cro4 + 2h2ALBO
R2Cro4 + 2hcro4- ⇔ 2rhcro4 + Cro42-
R2Cro4 + Hcro4- + H+ ⇔ r2Cr2ALBO7 + H2ALBO
Dla każdego mol r2Cro4 Przekształcenie jednego mol Cr (vi) roztworu jest usuwane, co czyni tę metodę bardzo atrakcyjną.
Po usunięciu chromatów żywica jest traktowana silnie alkalicznym roztworem, aby je zregenerować w bezpiecznym miejscu. Następnie chromaty są przekształcane w stężony kwas chromowy, aby ponownie wykorzystać.
Poprzez regenerację elektrochemiczną
Inną metodą jest elektrochemiczna regeneracja kwasu chromowego, która jest również bardzo wygodną alternatywą. Poprzez tę procedurę chrom (III) jest utleniany utleniany do chromu (VI). Materiał anodowy w tych przypadkach jest najlepiej ołowiany dwutlenek.
Zastosowanie mikroorganizmów do czyszczenia ścieków za pomocą kwasu chromowego
Metodą, która została zbadana i jest nadal badana, jest zastosowanie mikroorganizmów obecnych naturalnie w niektórych ściekach zanieczyszczonych heksawalentnymi jonami chromowymi, które są zawartością roztworów kwasu chromowego.
 Szkodliwe ścieki dla środowiska. Autor: OpencLipart-Vectors. Źródło: Pixabay.
Szkodliwe ścieki dla środowiska. Autor: OpencLipart-Vectors. Źródło: Pixabay. Tak jest w przypadku niektórych bakterii obecnych w opalonych wodach ścieków. Te drobnoustroje zostały zbadane i ustalone, że są odporne na chromenty i są również w stanie zmniejszyć chrom (VI) do chromu (III), co jest znacznie mniej szkodliwe dla środowiska i żywych istot.
Z tego powodu szacuje się, że można je stosować jako metodę środowiska dla naprawy i detoksykacji ścieków zanieczyszczonych kwasem chromowym.
Ryzyko kwasu chromowego i tlenek chromu
Cro3 To nie jest paliwo, ale może zintensyfikować spalanie innych substancji. Wiele twoich reakcji może powodować ogień lub eksplozję.
Cro3 a roztwory kwasu chromowego są silną drażniącą skórą (mogą powodować zapalenie skóry), oczy (mogą je spalić) i błony śluzowe (mogą powodować oskrzela) i mogą powodować „Pulls Chrome” w układzie oddechowym w układzie oddechowym.
Związki chromowe (VI), takie jak kwas chromowy i tlenek chromowy, są bardzo toksyczne, mutagenne i rakotwórcze dla większości żywych istot.
Bibliografia
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- LUB.S. National Library of Medicine. (2019). Kwas chromowy. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Wegman, r.F. i van Twin, j. (2013). Stopy aluminium i aluminium. 2.5. Proces anodizacji kwasu chromowego. W technikach przygotowania powierzchni do wiązania kleju (wydanie drugie). Odzyskane z naukowym.com.
- Wegman, r.F. i van Twin, j. (2013). Magnez. 6.4. Przygotowanie stopów magnezu i magnezu przez procesy obróbki kwasu chromowego. W technikach przygotowania powierzchni do wiązania kleju (wydanie drugie). Odzyskane z naukowym.com.
- Grot, w. (2011). Aplikacje. 5.1.8. Regeneracja kwasu chromowego. W fluorowanych jonomerach (wydanie drugie). Odzyskane z naukowym.com.
- Swift, k.G. i Booker, J.D. (2013). Proces inżynierii powierzchni. 9.7. Chromowanie. W podręczniku wyboru procesu produkcyjnego. Odzyskane z naukowym.com.
- Poulson, a.H.C. i in. (2019). Techniki modyfikacji powierzchni PEEK, w tym obróbka powierzchni w osoczu. jedenaście.3.2.1. Trawienie powierzchniowe. W Peek Biomaterials Handbook (wydanie drugie). Odzyskane z naukowym.com.
- Westheimer, f.H. (1949). Mechanizmy utleniania kwasu chromowego. Recenzje chemiczne 1949, 45, 3, 419-451. Odzyskane z pubów.ACS.org.
- Tan, h.K.S. (1999). Renowacja kwasu chromowego przez wymianę anionową. The Canadian Journal of Chemical Engineering, tom 77, luty 1999. Pobrano z biblioteki online.Wiley.com.
- Kabir, m.M. i in. (2018). Izolacja i charakterystyka bakterii redukujących chrom (VI) z ścieków garbników i odpadów stałych. World Journal of Microbiology and Biotechnology (2018) 34: 126. NCBI odzyskało.NLM.Nih.Gov.
- « Charakterystyka krajobrazu przemysłowego, elementy i przykłady
- Struktura cząsteczkowa kwas cyjanhydowy, właściwości, stosuje »

