Struktura cząsteczkowa kwas cyjanhydowy, właściwości, stosuje

- 3289
- 835
- Paweł Malinowski
On Kwas hydrocyjanowy o Wodór cyjanku jest związkiem organicznym, którego wzorem chemicznym jest HCN. Jest również znany jako metanonitil.
Kwas cyjanhydowy jest bezbarwnym, wyjątkowo trującym gazem, który jest uzyskiwany podczas leczenia cyjanków kwasami. Kwas ten znajduje się wewnątrz zadługo ziarna, znanego również w wielu miejscach jako brzoskwinia.
 Nasiona brzoskwini, które zawierają cyjanek lub cyjanek wodoru, HCN. Jakiś.Ha [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikipedia Commons.
Nasiona brzoskwini, które zawierają cyjanek lub cyjanek wodoru, HCN. Jakiś.Ha [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikipedia Commons. W temperaturze otoczenia mniejszej niż 25 ° C to ciecz, a powyżej tej temperatury jest gaz. W obu przypadkach jest to niezwykle toksyczne dla ludzi, zwierząt, a nawet większości mikroorganizmów. To dobry rozpuszczalnik dla jonów. Jest bardzo niestabilny, ponieważ ma tendencję do łatwo polimeryzacji.
Występuje w królestwie warzywnym włączonym do cząsteczek niektórych glukozydów, ponieważ gdy są one hydrolizowane przez enzymy warzyw, hCN, glukozę i benzaldehyd otrzymuje.
Te glukozydy znajdują się wewnątrz nasion niektórych owoców, takich jak brzoskwinie, morela, wiśnie, śliwki i gorzkie migdały, więc nigdy nie powinny być przyjmowane.
Występuje również w roślinach, takich jak niektóre rodzaje sorgo. Ponadto niektóre bakterie wytwarzają je podczas metabolizmu. Jest stosowany głównie w produkcji polimerów i w niektórych procesach metalurgicznych.
HCN jest śmiertelną trucizną z powodu wdychania, spożycia i kontaktu. Jest obecny w dymie papierosu i dymu ognia tworzyw sztucznych i materiałów zawierających węgiel i azot. Uważa się, że zanieczyszczenie powietrza wystąpiło podczas spalania materiału organicznego z rozległych obszarów planety.
[TOC]
Struktura molekularna i konfiguracja elektroniczna
Wodór cyjankowy lub kwas cyjanowy jest kowalencyjnym, molekularnym związkiem z atomem wodoru, węglem i jednym azotem.
Atom węgla i azotu mają 3 pary elektronów, więc tworzą potrójne ogniwo. Wodór jest powiązany z węglem, który z tym związkiem przedstawia swoją Valencia de Cuatro i pełny okett elektronowy.
Azot przedstawia pięć pięciu walencji, a do ukończenia okTETU ma parę znikniętych lub samotnych elektronów zlokalizowanych bocznie.
HCN jest zatem całkowicie liniową cząsteczką, z kilkoma brakującymi elektronami zlokalizowanymi bocznie w azotu.
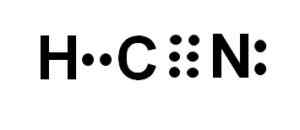 Lewis reprezentacja kwasu cyjanhydowego, w którym obserwuje się elektrony dzielone w każdym wiązaniu i parę samotnych elektronów azotowych. Autor: Marilú Stea.
Lewis reprezentacja kwasu cyjanhydowego, w którym obserwuje się elektrony dzielone w każdym wiązaniu i parę samotnych elektronów azotowych. Autor: Marilú Stea. 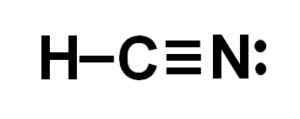 Struktura cyjankowodoru lub cyjankową, w której obserwuje się potrójne wiązanie między węglem a azotem. Autor: Marilú Stea.
Struktura cyjankowodoru lub cyjankową, w której obserwuje się potrójne wiązanie między węglem a azotem. Autor: Marilú Stea. Nomenklatura
- Kwas hydrocyjanowy
- Cyjan wodoru
- Metanonitryl
- Formonitryl
- Kwas hydrocyjanowy
Nieruchomości
Stan fizyczny
Poniżej 25,6 °. Jeśli jest powyżej tej temperatury jest niezwykle trującym bezbarwnym gazem.
Waga molekularna
27,03 g/mol
Temperatura topnienia
-13,28 ºC
Punkt wrzenia
25,63 ° C (pamiętaj, że gotuje się tuż powyżej temperatury otoczenia).
Temperatura zapłonu
-18 ° C (metoda zamkniętej kubka)
Temperatura samokierowania
538 ° C
Może ci służyć: chromatografia gazowaGęstość
0,6875 g/cm3 w 20 ° C
Rozpuszczalność
Całkowicie mieszane z wodą, alkoholem etylowym i eterem etylowym.
Stała dysocjacji
K = 2,1 x 10-9
PkDo = 9.2 (to bardzo słaby kwas)
Niektóre właściwości chemiczne
HCN ma bardzo wysoką stałą dielektryczną (107 do 25 ° C). Wynika to z faktu, że ich cząsteczki są bardzo polarne i są powiązane przez mosty wodoru, jak w przypadku wody H2ALBO.
Ponieważ posiadanie tak wysokiej stałej dielektrycznej HCN okazuje się dobrym rozpuszczalnikiem jonizującym.
Ciekawy bezwodny HCN jest bardzo niestabilny, ma tendencję do gwałtownego polimeryzacji. Aby tego uniknąć, dodaje się stabilizatory, jako niewielki procent H2południowy zachód4.
W roztworze wodnym oraz w obecności amoniaku i postaci adeniny pod wysokim ciśnieniem, związek, który jest częścią DNA i RNA, to znaczy biologicznie ważnej cząsteczki.
Jest bardzo słaby kwasem, ponieważ jego stała jonizacji jest bardzo mała, więc jest tylko częściowo w wodzie, dając cyjankowi anionowi CN-. Tworzyć sole z podstawami, ale nie z węglanami.
Jego wodne roztwory, które nie są chronione przed światłem, są powoli rozkładane generującą formatę amonową hCoonh4.
W roztworze przedstawia słaby zapach migdałów.
Korozja
Ponieważ jest to słaby kwas, na ogół nie jest żrący.
Jednak roztwory wodne HCN zawierające kwas siarkowy jako stabilizator silnie atakuje stal w temperaturach większych niż 40 ° C i stal nierdzewna w temperaturach większych niż 80 ° C.
Ponadto rozcieńczone HCN roztwory wodne mogą powodować stal węglową nawet w temperaturze pokojowej.
Możesz także zaatakować niektóre rodzaje gumowe, tworzywa sztuczne i powłoki.
Lokalizacja w naturze
Jest stosunkowo obfity w królestwie roślinnym, który jest częścią glukozydów.
Na przykład jest generowany z migdałków C6H5-CH (-CN) -o-glikozo-glikoza, związek obecny w gorzkich migdałach. Migdałk jest cyjanogennym beta-glukozydem, ponieważ po hydrolizie tworzy dwie cząsteczki glukozy, jeden z benzaldehydu i jeden z HCN. Enzym, który je uwalnia, to beta-glukoksydaza.
Migdałek można znaleźć w nasionach brzoskwiń, moreli, gorzkich migdałów, wiśni i śliwkach.
Niektóre rodzaje roślin sorgo zawierają cyjanogenny glucóside zwany durrina (to znaczy p-hydroksy- (S) -Mandelonitrilo-beta-d-glukozyd). Ten związek można degradować za pomocą hydrolizy enzymatycznej dwóch stóp.
Po pierwsze, enzym Durrinosa, który jest endogenny w sorgo, rośnie hydryny z glukozą i p-hydroksy- (S) -Mandelonitilo. Następnie ten ostatni szybko staje się wolnym HCN i p-hydroksybenzaldehydu.
 Roślina sorgo z wysoką zawartością Durriny. Nie dostarczył autora, który można odczytać w maszynie. Pethan założył (na podstawie roszczeń dotyczących praw autorskich). [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikipedia Commons.
Roślina sorgo z wysoką zawartością Durriny. Nie dostarczył autora, który można odczytać w maszynie. Pethan założył (na podstawie roszczeń dotyczących praw autorskich). [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikipedia Commons. HCN jest odpowiedzialny za odporność roślin sorgo w kierunku szkodników i patogenów.
Wyjaśnia to fakt, że enzym Durrina i Durrinosa mają różne lokalizacje w tych roślinach i kontaktują się tylko wtedy, gdy tkanki są ranne lub zniszczone, uwalniając HCN i chroniąc roślinę infekcji, które mogłyby przeniknąć przez uszkodzoną partię.
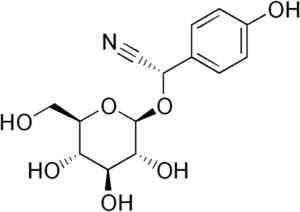 Cząsteczka Durrina, w której zaobserwuje się potrójne wiązanie CN, że przez hydrolizę enzymatyczną wytwarza HCN. Edgar181 [domena publiczna]. Źródło: Wikipedia Commons.
Cząsteczka Durrina, w której zaobserwuje się potrójne wiązanie CN, że przez hydrolizę enzymatyczną wytwarza HCN. Edgar181 [domena publiczna]. Źródło: Wikipedia Commons. Dodatkowo niektóre patogenne bakterie człowieka, takie jak Pseudomonas aeruginosa I P. Gingivalis Produkują to podczas aktywności metabolicznej.
Aplikacje
W przygotowaniu innych związków chemicznych i polimerów
Zastosowanie większości HCN wyprodukowanej na poziomie przemysłowym jest przygotowanie pośredników do syntezy organicznej.
Może ci służyć: tlenek żelaza (ii): struktura, nomenklatura, właściwości, zastosowaniaJest stosowany w syntezie adiponitrylu NC- (CH2)4-CN, który służy do przygotowania nylonu lub nylonu, poliamidu. Służy również do przygotowania Acrilonitrilo lub Cianoetylenu Cho2= CH-CN, używany do przygotowywania włókien akrylowych i plastikowych.
Jego pochodny cyjanku sodu jest stosowany do odzyskiwania złota w wydobyciu tego metalu.
Kolejny z jego pochodnych CLCN Cyanogen Chlorek służy do formuł pestycydów.
HCN służy do przygotowania środków chelatujących, takich jak EDTA (etylen-diamino-tetra-acetato).
Służy do produkcji ferrocyjanobów i niektórych produktów farmaceutycznych.
Różne zastosowania
Gaz HCN był używany jako owadobójczy, fungicydu i środka dezynfekującego, do fumigacji statku i budynków. Również w celu fumigacji mebli, aby je przywrócić.
HCN był używany w metalowym lakierze.
Za jego bardzo wysoką toksyczność został mianowany agentem wojennym chemicznym.
W rolnictwie
Był używany jako herbicyd i pestycyd w sadach. Miał użyć do kontrolowania skal i innych patogenów drzew cytrusowych, ale niektóre z tych szkodników stały się odporne na HCN.
Został również użyty do fumigacji silosów ziarna. Gasowy HCN przygotowany na miejscu został wykorzystany w fumigacji ziaren pszenicy, aby zachować je ze szkodników, takich jak owady, grzyby i gryzonie. Do tego zastosowania konieczne jest, aby nasiona były fumigowane do środka pestycydów.
Testy fumigujące nasiona pszenicy zostały wykonane z HCN i stwierdzono, że ich potencjał kiełkowania nie wpływa negatywnie, raczej wydaje się, że faworyzuje.
Jednak wysokie dawki HCN mogą znacznie zmniejszyć długość małych liści, które wyrastają z nasion.
Z drugiej strony, ze względu na fakt, że jest to potężny nicień i że niektóre rośliny sorgo posiadają go w swoich tkankach, potencjał roślin sorgo jest badany do stosowania jako biocid zielonego nawozu.
Jego zastosowanie służyłoby do poprawy gleb, tłumienia chwastów i kontroli chorób oraz szkód spowodowanych przez fitoparazowe nicienie.
Ryzyko
Dla istoty ludzkiej HCN jest śmiertelną trucizną na wszystkich trasach: wdychanie, spożycie i kontakt.
 Autor: Clker-Free-Vector-Images. Źródło: Pixabay.
Autor: Clker-Free-Vector-Images. Źródło: Pixabay. Wdychane może być śmiertelne. Szacuje się, że około 60–70% populacji może wykryć zapach gorzkich migdałów HCN, gdy jest w powietrzu w stężeniu 1-5 ppm.
Ale istnieje 20% populacji, która nadal nie może wykryć tego w śmiertelnych stężeniach za to, że nie jest w stanie tego zrobić genetycznie.
Spożywa się ostra i natychmiastowa trucizna działania.
Jeśli twoje rozwiązania kontaktują się ze skórą, powiązany cyjanek może być śmiertelny.
HCN jest obecny w dymie papierosowym, a ten, który jest wytwarzany, gdy tworzywa sztuczne zawierające azot są spalane.
Śmiertelny mechanizm działania w organizmie
Jest chemikalia i szybko toksyczna, często prowadzi do śmierci. Po wejściu do organizmu dołącza do metaloenzymów (enzymy zawierające jon metalowy). Jest to czynnik toksyczny dla kilku narządów ludzkiego ciała
Jego główny toksyczny efekt polega na hamowaniu oddychania komórkowego, ponieważ dezaktywuje enzym, który wpływa na fosforylację w mitochondriach, które są organelami, które interweniują między innymi w funkcji oddechowej komórek.
Może ci służyć: permanganan potasu (KMNO4)Ryzyko dymu papierosowego
HCN jest obecny w dymie papierosowym.
Chociaż wiele osób zna efekt zatrucia HCN, niewiele osób zdaje sobie sprawę, że są narażeni na swój szkodliwy wpływ poprzez dym papierosowy.
HCN jest jedną z przyczyn hamowania kilku komórkowych enzymów oddechowych. Ilość HCN obecna w dymie papierosowym ma szkodliwy wpływ na układ nerwowy.
Poziomy HCN odnotowano w dymie papierosowym od 10 do 400 μg na papierosy dla dymu bezpośrednio i 0,006 do 0,27 μg/papieros do wtórnego inhalacji (palacz pasywny). HCN powoduje toksyczne efekty od 40 μm dalej.
 Autor: Zdjęcia Alexas. Źródło: Pixabay.
Autor: Zdjęcia Alexas. Źródło: Pixabay. Wdychanie szybko wchodzi do krwioobiegu, gdzie jest uwalniany w osoczu lub wiąże się z hemoglobiną. Mała część nawróca się na tiocianato i jest wydalana przez mocz.
Ryzyko ogrzewania HCN
Przedłużone narażenie na ciepło płynnego HCN w zamkniętych pojemnikach może powodować gwałtowne i nieoczekiwane pęknięcie. Może wybuchowo polimeryzować 50-60 ° C w obecności śladów alkalicznych i przy braku inhibitorów.
Obecność HCN w dymie ogniowym
HCN jest uwalniany podczas spalania polimerów zawierających między innymi azot, taki jak wełna, jedwab, poliakrylonitilos i nylon. Materiały te są obecne w naszych domach i w większości miejsc działalności człowieka.
Z tego powodu podczas pożarów HCN może potencjalnie być przyczyną śmierci przez wdychanie.
Zanieczyszczenie atmosfery
HCN jest zanieczyszczeniem troposfery. Jest odporny na fotolysis i w warunkach środowiskowych atmosfery nie cierpi hydrolizy.
OH rodniki hydroksylowe • Wytworzone fotochemicznie mogą reagować z HCN, ale reakcja jest bardzo powolna, więc pół -life HCN w atmosferze wynosi 2 lata.
Kiedy biomasa pali, zwłaszcza mob, HCN jest uwalniany do atmosfery, a także podczas działań przemysłowych. Jednak spalanie torfowe jest 5 do 10 razy bardziej zanieczyszczenia niż spalanie innego rodzaju biomasy.
Niektórzy badacze odkryli, że wysokie temperatury i susza spowodowane przez zjawisko El Niño w niektórych obszarach zaostrzenia planety.
 Autor: Steve Buissinne. Źródło: Pixabay.
Autor: Steve Buissinne. Źródło: Pixabay. To prowadzi do intensywnego oparzenia biomasy na suchych stacjach.
Zdarzenia te są źródłem wysokich stężeń HCN w troposferze, które ostatecznie są transportowane do niskiej stratosfery, pozostając przez bardzo długi czas.
Bibliografia
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- LUB.S. National Library of Medicine. (2019). Cyjan wodoru. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Gidlow, zm. (2017). Aktualizacja cyjankowodoru-aktualizacja. Medycyna zawodowa 2017; 67: 662-663. NCBI odzyskało.NLM.Nih.Gov.
- Encyklopedia naukowa Van Nostrand. (2005). Cyjan wodoru. 9th Pobrano z biblioteki online.Wiley.com.
- Ren i.-L. i in. (1996). Wpływ cyjankowodoru i siarczku karbonylowego na kiełkowanie i wiązanie pszenicy pszenicy. Pestic. Sci. 1996, 47, 1-5. Pobrano z biblioteki online.Wiley.com.
- Od Nicoli, G.R. i in. (2011). Do prostej metody analitycznej oceny zawartości dhurryny w roślinach cyjanogennych do ich zastosowania w paszach i biofumigacji. J. Rolnictwo. Żywność Chem. 2011, 59, 8065-8069. Odzyskane z pubów.ACS.org.
- Sheese, s.I. i in. (2017). Globalne wzmocnienie cyjankowodoru w niższej stratosferze Throepout 2016. Geofii. Wołowina. Łotysz., 44, 5791-5797. Odzyskane z agupubów.Biblioteka online.Wiley.com.
- Surleva, a.R. i Drochioiu, G. (2013). Wizualizacja zagrożenie dla palenia: proste spektrofotometryczne oznaczanie cyjanku wodoru w dymie papierosowym i filtrom. J. Chem. Edukacja. 2013, 90, 1654-1657. Odzyskane z pubów.ACS.org.
- Alarie i. i in. (1990). Rola cyjankowodoru w ludzkich śmierci w ogniu. W ogniu i polimerach. Rozdział 3. Seria Sympozjum ACS. Odzyskane z pubów.ACS.org.
- « Struktura kwasu chromowego, właściwości, uzyskiwanie, zastosowania
- 8 eksperymentów z bardzo kontrowersyjnymi ludźmi »

