Kwas karboksylowy
- 1086
- 256
- Maksymilian Kępa
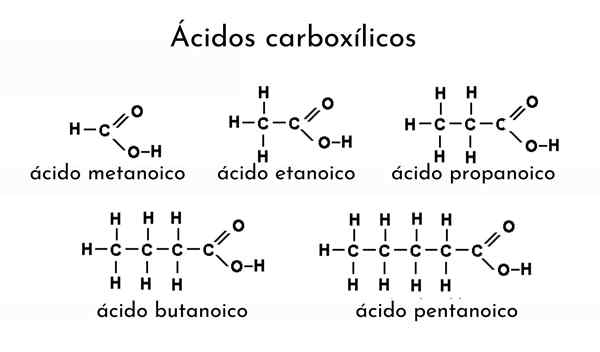
 Przykłady kwasów karboksylowych
Przykłady kwasów karboksylowych Jakie są kwasy karboksylowe?
On kwas karboksylowy Jest to termin przypisywany dowolnym związku organicznym zawierającym grupę karboksylową. Można je również nazwać kwasami organicznymi i są obecne w wielu naturalnych źródłach. Na przykład od mrówek i innych owadów, takich jak chrząszcz galerytowy, kwas mrówkowy, kwas karboksylowy jest destylowany.
Oznacza to, że Anthill jest źródłem bogatym w kwas mrówkowy. Również kwas octowy jest ekstrahowany z octu, zapach zjełczonego masła jest spowodowany kwasem masrynowym, zioła waleria zawierają kwas mózgu i z otrzymywanych czapek kwas kaprysowych, wszystkich tych kwasów karboksylowych.
Kwas mlekowy daje zły smak kwaśnego mleka, aw niektórych tłuszczach i olejach obecne są kwasy tłuszczowe. Przykłady naturalnych źródeł kwasów karboksylowych są niezliczone, ale wszystkie przypisane nazwy pochodzą ze słów po łacinie. Tak więc po łacinie słowo Formica oznacza „mrówka”.
Ponieważ kwasy te zostały wyodrębnione w różnych rozdziałach historii, nazwy te były powszechne, konsolidujące w kulturze popularnej.
Formuła
Ogólna formuła kwasu karboksylowego jest -r -cooh, Lub więcej szczegółów: R- (c = o) -OH. Atom węgla jest powiązany z dwoma atomami tlenu, co powoduje spadek jego gęstości elektronicznej, a w konsekwencji dodatnie obciążenie częściowe.
Obciążenie to odzwierciedla stan utleniania węgla w związku organicznym. W dowolnym innym węglu jest tak zardzewiały, jak w przypadku kwasów karboksylowych, a utlenianie jest proporcjonalne do stopnia reaktywności istoty związku.
Z tego powodu grupa -COOH ma przewagę w stosunku do innych grup organicznych i definiuje główny charakter gazowany i główny węglany łańcuch związku.
Stąd nie ma kwasowych pochodnych amin (R-NH2), ale amino pochodzące z kwasów karboksylowych (aminokwasy).
Nomenklatura
Wspólne nazwy pochodzące z łaciny dla kwasów karboksylowych nie wyjaśniają struktury związku ani ich rozmieszczenia lub rozmieszczenia ich grup atomów.
Biorąc pod uwagę potrzebę tych wyjaśnień, systematyczna nomenklatura IUPAC pojawia się w nazwie kwasów karboksylowych.
Może ci służyć: brom: historia, struktura, konfiguracja elektroniczna, właściwości, użyciaTa nomenklatura podlega kilku zasadom, a niektóre z nich to:
Zasada nr 1
Aby wymienić kwas karboksylowy, nazwa jego alkanów musi zostać zmodyfikowana, dodając sufiks „ICO”. Tak więc dla etanu (wybierz3-Ch3) Jego odpowiadającym kwasem karboksylowym jest kwas etanowy (CH3-COOH, kwas octowy, taki sam octu).
Inny przykład: dla Cho3Ch2Ch2-Cooh el alcano staje się butanem (ch3Ch2Ch2Ch3), a zatem wyznacza się kwas butanowy (kwas masłowy, to samo z zjełczałego masła).
Zasada 2
Grupa -cooh definiuje łańcuch główny, a liczba odpowiadająca każdemu węglowi jest liczona z karbonyl.
Na przykład Cho3Ch2Ch2Ch2-COOH to kwas pentanowy, który liczy się od jednego do pięciu węgli do metylu (wybierz3). Gdyby inna grupa metylowa jest powiązana z trzecim węglem, byłby to Cho3Ch2CH (rozdz3) Ch2-COOH, będąc teraz wynikową nomenklaturą: kwas 3-metylopentanowy.
Zasada 3
Podstawniki są poprzedzone liczbą węgla, z którym są powiązane. Podobnie te podstawniki mogą być podwójnymi lub potrójnymi linkami i dodać sufiks „ICO” w równym stopniu do alkenów i alkin. Na przykład Cho3Ch2Ch2CH = CHCH2-COOH jest wspomniany jako kwas (cis lub trans) 3-heptenoiczny.
Zasada 4
Kiedy łańcuch R składa się z pierścienia (φ). Kwas jest wspomniany, zaczynając od nazwy pierścienia i kończąc na sufiks „karboksylowy”. Na przykład φ-COOH jest nazwany kwasem benzenerokarboksylowym.
Struktura kwasu karboksylowego
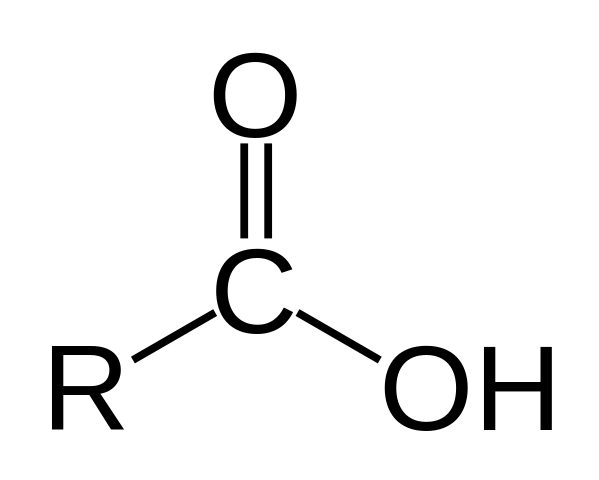 Struktura kwasu karboksylowego. R jest wodorem lub łańcuchem gazowanym.
Struktura kwasu karboksylowego. R jest wodorem lub łańcuchem gazowanym. Na górnym obrazie reprezentuje ogólna struktura kwasu karboksylowego. Łańcuch boczny R może być o dowolnej długości lub posiadać wszelkiego rodzaju podstawniki.
Atom węgla ma hybrydyzację SP2, co pozwala zaakceptować podwójne wiązanie i wygenerować kąty łącza około 120º.
Dlatego tę grupę można zasymilować jako płaski trójkąt. Górny tlen jest bogaty w elektrony, podczas gdy dolny wodór jest słaby w elektronach, stając się wodorem kwasowym (akceptor elektronów). Można to zaobserwować w strukturach rezonansu podwójnego.
Wodór jest przypisywany do zasady i z tego powodu struktura ta odpowiada związku kwasu.
Może ci służyć: aminyWłaściwości kwasu karboksylowego
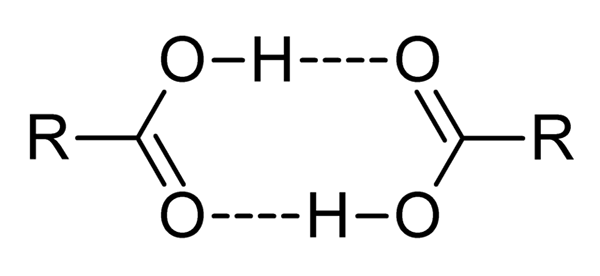
Kwasy karboksylowe to bardzo polarne związki, intensywne zapachy i z łatwością skutecznego oddziaływania ze sobą przez mosty wodorowe, jak ilustrują obrazek nadrzędny.
Kiedy dwa kwasy karboksylowe oddziałują w ten sposób, tworzone są dímeros, niektóre wystarczająco stabilne, aby istnieć w fazie gazowej.
Hydrogen i mosty o średnicy powodują, że kwasy karboksylowe mają wyższe tematy wrzenia niż woda. Wynika to z faktu, że energia podana w cieple musi odparować nie tylko cząsteczki, ale z dimerem, również połączoną przez te mosty wodorowe.
Małe kwasy karboksylowe czują się wielkie powinowactwo do wody i rozpuszczalników polarnych. Jednak gdy liczba atomów węgla jest większa niż cztery, dominuje hydrofobowy charakter łańcuchów R i staje się niemieszczony z wodą.
W fazie stałej lub ciekłej długość łańcucha R i podstawy, które ma, odgrywają ważną rolę. Zatem, gdy łańcuchy są bardzo długie, wchodzą ze sobą przez londyńskie siły dyspersji, jak w przypadku kwasów tłuszczowych.
Kwasowość
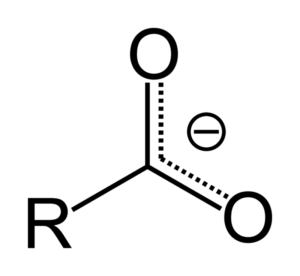
Kiedy kwas karboksylowy przekazuje proton, staje się on anionem karboksylanowym, reprezentowanym na górnym obrazie. W tym anionie obciążenie ujemne jest przenoszone między dwoma atomami węgla, stabilizując go, a zatem faworyzując reakcję tak.
Jak różni się tę kwasowość od jednego kwasu karboksylowego do drugiego? Wszystko zależy od kwasowości protonu w grupie OH: im gorszy w elektronach, tym więcej kwasu.
Kwasowość można zwiększyć, jeśli jednym z podstawników łańcucha RA jest gatunkiem elektroonegatywnym (który przyciąga lub wycofuje gęstość elektroniczną z otoczenia).
Na przykład, jeśli w Cho3-COOH jest zastępuje H grupy metylowej atomem fluorowym (CFH2-COOH) Kwasowość znacznie wzrasta, ponieważ F wycofuje gęstość elektroniczną z karbonylu, tlenu, a następnie wodoru. Jeśli wszystkie H zostaną zastąpione przez F (CF3-COOH) kwasowość osiąga maksymalną wartość.
Może ci służyć: wodór: historia, struktura, właściwości i zastosowaniaJaka zmienna określa stopień kwasowości? PKDo. Im niższy PKDo A bliżej 1, większa jest zdolność kwasu do dysocjowania w wodzie, a z kolei bardziej niebezpieczna i szkodliwa. Z poprzedniego przykładu CF3-COOH ma najniższą wartość PKDo.
Używa/zastosowania kwasów karboksylowych
Ze względu na ogromną różnorodność kwasów karboksylowych, każdy z nich ma potencjalne zastosowanie w branży, czy to polimerów, farmaceutycznych czy żywności.
Przemysł spożywczy
- Dodatki.
- Konserwatywa (kwas sorbinowy i kwas benzoesowy).
- Regulator alkalizacji wielu produktów.
- Produkcja napojów bezalkoholowych.
- Środki przeciwdrobnoustrojowe przed działaniem przeciwutleniaczy. W tym przypadku trend jest płynny przeciwdrobnoustrojowy.
- Główny składnik octu wspólnego (kwas octowy).
- Kwasulant w napojach gazowanych i żywności (kwas cytrynowy i kwas mlekowy).
- Asystent dojrzewania sera szwajcarskiego (kwas propionowy).
- Ser, chucrut, sfermentowane colm i napoje bezalkoholowe (kwas mlekowy).
Przemysł farmaceutyczny
- Antypieretyczne i przeciwbólowe (kwas acetylosalicylowy).
- Aktywny w procesie syntezy aromatu, w niektórych lekach (butyryk lub kwas butanowy).
- Środki przeciwmekotyczne (kwas benzoesowy w połączeniu z kwasem salicylowym).
- Aktywne do produkcji leków witaminowych C (kwas askorbinowy).
- Grzybobójca (kwas kaprylowy).
- Produkcja niektórych środków przeczyszczających (kwas hydroksybothanodowy).
Inne branże
- Produkcja tworzyw sztucznych i smarów (kwas sorbinowy).
- Produkcja lakierów, elastycznych żywic i przezroczystych klejów (kwas akrylowy).
- Produkcja obrazów i lakierów (kwas linolowy).
- Produkcja mydeł, detergentów, szamponów, kosmetyków i czyszczenia metali (kwas oleinowy).
- Produkcja makaronu dentystycznego (kwas salicylowy).
- Produkcja octanu octanu Rayona, filmy fotograficzne i rozpuszczalniki do farb (kwas octowy).
- Barwnik i opalona produkcja (kwas metanowy).
- Przygotowanie olejków środków smarowych, wodoodpornych materiałów i obrazów sekundowych (kwas palmitynowy).
- Produkcja gumy (kwas octowy).
- Opracowanie gumowe i galwanoplastyka.
- Rozpuszczalnik.
- Produkcja perfum (kwas benzoesowy).
- Produkcja plastyfikatorów i żywic (kwas fotograficzny).
- Opracowanie poliestrowe (kwas tereftaliczny).
- Przygotowanie świec parafinowych (kwas stearynowy).
Bibliografia
- Graham Solomons t.W., Craig b. Fryhle. Chemia organiczna. Kwasy karboksylowe i ich pochodne (wydanie 10., strona 779-783). Wiley Plus.
- Kwasy organiczne. Naturalwellbeing wyzdrowiał.com
- Francis a. Szylkret. Chemia organiczna. Kwasy karboksylowe. (Szósta edycja., Strona 805-820). MC Graw Hill.
- William Reusch. Kwasy karboksylowe. Odzyskane z chemii.MSU.Edu
- « Charakterystyka i czynniki ryzyka różnorodności biologicznej w Meksyku
- 5 gałęzi głównej biotechnologii »

