Struktura kwasu węglowego (H2CO3), właściwości, synteza, zastosowania

- 4059
- 1058
- Eliasz Dubiel
On kwas węglowy Jest to związek nieorganiczny, chociaż są tacy, którzy debatują, że w rzeczywistości jest organiczna, której formuła chemiczna to h2WSPÓŁ3. Jest to zatem kwas dioprotyczny, który jest w stanie przekazać dwa jony H+ do środowiska wodnego w celu wygenerowania dwóch kationów molekularnych h3ALBO+. Od niego powstają dobrze znane jony wodorowęglanowe (HCO3-) i węglan (co32-).
Ten szczególny kwas, prosty, ale jednocześnie zaangażowany w systemy, w których liczne gatunki uczestniczą w równowadze ciekłej wapki, powstaje z dwóch podstawowych cząsteczek nieorganicznych: wody i dwutlenku węgla. Obecność CO2 Informuje się zawsze, że w wodzie jest pęcherz, wstępujący do powierzchni.
 Szkło z wodą z gazu, jeden z najczęstszych napojów zawierających kwas węglowy. Źródło: Pxhere.
Szkło z wodą z gazu, jeden z najczęstszych napojów zawierających kwas węglowy. Źródło: Pxhere. Zjawisko to jest regularnie obserwowane w napojach bezalkoholowych i wodach gazowanych.
W przypadku wody gazowanej lub wysagifikowanej (obraz doskonały) taka ilość została rozpuszczona2 że twoje ciśnienie pary to ponad podwójne ciśnienie atmosferyczne. Odkrywając go, różnica ciśnienia w butelce i zewnętrznej części zmniejsza rozpuszczalność CO2, Więc pęcherzyki, które kończą się na ucieczce, pojawiają się płyn.
W mniejszym stopniu to samo dzieje się w każdej masie świeżej lub soli fizjologicznej: kiedy je podgrzewają, uwolnią swoją rozpuszczoną zawartość CO2.
Jednak CO2 Jest nie tylko rozpuszczony, ale cierpi transformacje w swojej cząsteczce, które czyni ją h2WSPÓŁ3; Kwas, który ma bardzo niewielkie życie, ale wystarczająco, aby zaznaczyć hipnotowalną zmianę pH jego wodnego środowiska rozpuszczalnika, a także wygenerować unikalny system bufora węglanowego.
[TOC]
Struktura
Cząsteczka
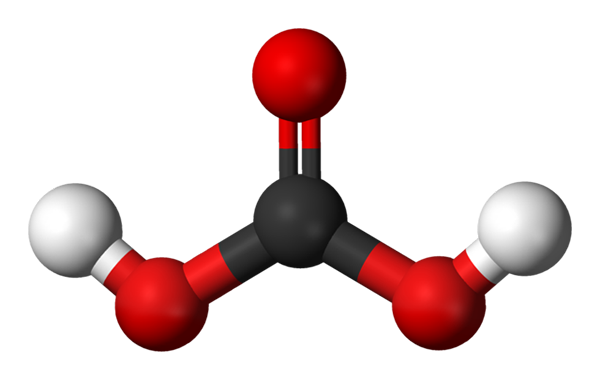 Cząsteczka kwasu węglowego reprezentowana za pomocą modelu sfer i słupków. Źródło: Jynto i Ben Mills przez Wikipedię.
Cząsteczka kwasu węglowego reprezentowana za pomocą modelu sfer i słupków. Źródło: Jynto i Ben Mills przez Wikipedię. W górę mamy cząsteczkę H2WSPÓŁ3, reprezentowane z kulami i prętami. Czerwone kule odpowiadają atomom tlenu, atomem czarnym do węgla i białymi atomami wodoru.
Zauważ, że zaczynając od obrazu, możesz napisać kolejną prawidłową formułę dla tego kwasu: CO (OH)2, gdzie CO staje się grupą karbonylową, C = O, połączoną z dwiema grupami hydroksylowymi, OH. Gdy istnieją dwie grupy OH, zdolne do przekazania ich atomów wodoru, teraz rozumie się, skąd pochodzą jony H+ Wydany w środku.
 Struktura molekularna kwasu węglowego.
Struktura molekularna kwasu węglowego. Zauważ, że Formuła CO (OH)2 Można to zapisać jako Ohcooh; to znaczy typ RCOOH, gdzie R staje się w tym przypadku grupa OH.
Z tego powodu, oprócz faktu, że cząsteczka składa się z tlenu, wodoru i atomów węgla, zbyt powszechnego w chemii organicznej, że kwas węglowy jest przez niektórych jako związek organiczny. Jednak w części syntezy zostanie wyjaśnione, dlaczego inni uważają ją za natury nieorganicznej i nieorganicznej.
Może ci służyć: dihydroksyaceton: struktura, właściwości, uzyskiwanie, użyciaInterakcje molekularne
Cząsteczki h2WSPÓŁ3 Można skomentować, że jego geometria jest płaska trygonalna, z węglem znajdującym się w środku trójkąta. W dwóch wierzchołkach ma grupy OH, które są dawcami mostu wodorowego; A w pozostałych innych atom tlenu grupy C = O, akceptor mostu wodorowego.
Tak więc h2WSPÓŁ3 Ma silną tendencję do interakcji z protekcjami lub natlenionymi rozpuszczalnikami (a także azotem).
I przypadkowo woda spełnia te dwie cechy, a powinowactwo H jest takie2WSPÓŁ3 Dla niej prawie natychmiast daje jej h+ I równowaga hydrolizy, która obejmuje gatunki HCO3- i H3ALBO+.
Właśnie dlatego sama obecność wody rozkłada kwas węglowy i sprawia, że jego izolacja jest zbyt skomplikowana.
Czysty kwas węglowy
Powrót do cząsteczki H2WSPÓŁ3, Jest nie tylko płaski, zdolny do ustanowienia mostów wodorowych, ale może również przedstawiać CIS-Trans Isomeía; Jest to, na obrazie mamy izomer cis, z dwoma H wskazującymi w tym samym kierunku, podczas gdy w izomerze trans wskazaliby w przeciwnych kierunkach.
Izomer CIS jest najbardziej stabilny z obu i dlatego jest jedynym, który zwykle jest reprezentowany.
Czysta substancja h2WSPÓŁ3 Składa się z krystalicznej struktury złożonej z warstw lub liści cząsteczek oddziałujących z bocznymi mostami wodorowymi. Jest to oczekiwane, będąc cząsteczką h2WSPÓŁ3 Płaski i trójkątny. Gdy pojawiają się podplimalne, pojawiają się cykliczne zmierzchu (h2WSPÓŁ3)2, które łączą dwa mosty wodorowe C = O - OH.
Symetria HR2WSPÓŁ3 Nie można go było zdefiniować przez chwile. Uznano go za krystalizowane jako dwa polimorfy: α-H2WSPÓŁ3 i β- H2WSPÓŁ3. Jednak α-H2WSPÓŁ3, zsyntetyzowane na podstawie mieszanki CHO3Cooh-Co2, Wykazano, że to właściwie Cho3OROH: Ster kwasu węglowego monometrii.
Nieruchomości
Wspomniano, że H2WSPÓŁ3 Jest to kwas dioprotyczny, dzięki czemu można przekazać dwa jony H+ do medium, które ich akceptuje. Gdy to medium jest wodą, równania jego dysocjacji lub hydrolizy to:
H2WSPÓŁ3(AC) + H2Lub (L) HCO3-(AC) + H3ALBO+(Ac) (ka1 = 2,5 × 10−4)
HCO3-(AC) + H2Lub (l) co32-(AC) + H3ALBO+(Ac) (ka2 = 4,69 × 10−11)
HCO3- Jest to wodorowęglan lub anion wodorowęglanowy i CO32- Anion węglanowy. Wskazują również swoje odpowiednie stałe równowagi, ka1 i Ka2. Bycie ka2 Pięć milionów razy mniejsze niż Ka1, Tworzenie i stężenie CO32- Są nikczemne.
Nawet jeśli jest to kwas dioprotyczny, drugi h+ Ledwo możesz to zwolnić. Jednak obecność CO2 rozpuszczone w dużych ilościach wystarczającej do zakwaszenia pożywki; W takim przypadku woda, obniżanie wartości pH (poniżej 7).
Może ci służyć: fusionMówienie o kwasu węglowym praktycznie odnosi się do roztworu wodnego, w którym dominują gatunki HCO3- i H3ALBO+; Nie można go izolować konwencjonalnymi metodami, ponieważ najmniejsze próby wyparłyby równowagę rozpuszczalności CO2 do tworzenia bąbelków, które uciekłyby z wody.
Synteza
Rozpuszczenie
Kwas węglowy jest jednym z najłatwiejszych związków do syntezy. Jak? Najprostszą metodą jest bąbelka, za pomocą słomy lub sorbetu, powietrze, które wydychujemy w objętości wody. Ponieważ wydychamy w istocie CO2, Ten bąbelek w wodzie, rozpuszczając niewielki ułamek tego samego.
Kiedy to robimy, następuje następująca reakcja:
WSPÓŁ2(g) + h2Lub (l) h2WSPÓŁ3(AC)
Ale z kolei należy rozważyć rozpuszczalność CO2 w wodzie:
WSPÓŁ2(g) co2(AC)
Oba co2 Jak h2Lub są cząsteczkami nieorganicznymi, więc h2WSPÓŁ3 Jest nieorganiczny, odkąd ten punkt widział.
Równowaga ciecz-vapor
W rezultacie mamy układ w równowadze, który zależy w dużej mierze od częściowych ciśnień CO2, a także temperatura cieczy.
Na przykład, jeśli ciśnienie CO2 Wzrasta (w przypadku, gdy powiemy powietrze z większą siłą przez sorbet), powstanie więcej H2WSPÓŁ3 a pH stanie się bardziej kwaśne; Ponieważ pierwsza równowaga porusza się w prawo.
Z drugiej strony, jeśli podgrzejemy rozwiązanie H2WSPÓŁ3, Rozpuszczalność CO zmniejszy2 W wodzie, ponieważ jest to gaz, a równowaga przesunie się w lewo (będzie mniej h2WSPÓŁ3). Podobne będzie, jeśli spróbujemy zastosować próżnię: co2 Ucieknie, a także cząsteczki wody, które ponownie przesuną równowagę w lewo.
Czysta stała
Powyższe pozwala wyciągnąć wniosek: z rozwiązania H2WSPÓŁ3 Nie ma sposobu na zsyntetyzację tego kwasu jako czystej substancji stałej za pomocą konwencjonalnej metody. Jednak zostało to zrobione od lat 90. ubiegłego wieku, zaczynając od solidnych mieszanin CO2 i H2ALBO.
Do tej solidnej mieszanki Co2-H2Lub przy 50% jest bombardowane protonami (rodzaj promieniowania kosmicznego), tak że żaden z dwóch elementów nie ucieknie, a tworzenie H zachodzi2WSPÓŁ3. W tym celu zastosowano również mieszankę cho3Oh-Co2 (Pamiętaj α-H2WSPÓŁ3).
Inną metodą jest robienie tego samego, ale bezpośrednio przy użyciu suchego lodu, nic więcej.
Z trzech metod naukowcy NASA mogą dojść do wniosku: czysty, stały lub gazowy kwas węglowy może istnieć w lodach Jowisza, w marsjańskich lodowcach i w kometach, gdzie takie stałe mieszaniny są stale napromieniowane dla promieni kosmicznych.
Może ci służyć: pipeta wolumetryczna: charakterystyka, zastosowania, kalibracja i błędyAplikacje
Sam kwas węglowy jest związkiem bez żadnej użyteczności. Z jego rozwiązań można jednak przygotować rozwiązania tłumienia oparte na rówieśnikach HCO3-/WSPÓŁ32- lub h2WSPÓŁ3/Hco3-.
Dzięki tym roztworom i działaniu enzymu anhydrazy węglowej, obecnej w czerwonych krwinkach, co2 Wyprodukowany podczas oddychania można przetransportować krew do płuc, gdzie w końcu zostaje zwolniony, aby zostać wydychanym poza naszym ciałem.
Bubjueo z CO2 Wykorzystuje gazę napojów przyjemne i charakterystyczne uczucie, które zostawiają w gardle podczas ich picia.
Także obecność H2WSPÓŁ3 Ma znaczenie geologiczne w tworzeniu wapiennych stalaktytów, ponieważ rozpuszcza je powoli, dopóki nie pochodzą one spiczaste wykończenia.
Z drugiej strony ich rozwiązania można wykorzystać do przygotowania metalowych wodorowęglanów; Chociaż jest bardziej opłacalny i łatwy w użyciu soli wodorowęglanowej (Nahco3, Na przykład).
Ryzyko
Kwas węglowy ma tak bardzo małe życie w normalnych warunkach (szacują, że około 300 nanosekund), co jest praktycznie nieszkodliwe dla środowiska i żywych istot. Jednak, jak wspomniano wcześniej, nie oznacza to, że nie może wygenerować niepokojącej zmiany pH wody oceanicznej, wpływając na faunę morską.
Z drugiej strony prawdziwe „ryzyko” jest w gazieniu wlotu, ponieważ ilość CO2 rozpuszczone w nich jest znacznie większe niż w normalnej wodzie. Jednak i znowu nie ma badań, które wykazały, że picie wody gazowej stanowi śmiertelne ryzyko; Jeśli nawet polecasz, aby pościć i zwalczać niestrawność.
Jedynym negatywnym efektem obserwowanym dla tych, którzy piją tę wodę, jest poczucie pełni, ponieważ ich żołądki są wypełnione gazami. Z tego (nie wspominając o napojach bezalkoholowych, ponieważ składają się one z znacznie więcej niż tylko kwas węglowy), można powiedzieć, że ten związek wcale nie jest toksyczny.
Bibliografia
- Dzień, r., & Underwood, a. (1989). Ilościowa chemia analityczna (ed.). Pearson Prentice Hall.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). KWAS WĘGLOWY. Źródło: w:.Wikipedia.org
- Danielle Reid. (2019). Kwas węglowy: tworzenie, struktura i równanie chemiczne wideo. Badanie. Odzyskane z: Study.com
- Götz Bucher i Wolfram Sander. (2014). Wyjaśnienie struktury kwasu węglowego. Tom. 346, wydanie 6209, pp. 544-545. Doi: 10.1126/Science.1260117
- Lynn Yarris. (22 października 2014). Nowe spostrzeżenia na temat kwasu węglowego w wodzie. Berkeley Lab. Odzyskane z: NewsCenter.lbl.Gov
- Claudia Hammond. (14 września 2015 r.). Jest dla ciebie błyszcząca woda? Źródło: BBC.com
- Jürgen Bernard. (2014). Stały i gazowy kwas węglowy. Instytut Chemii fizycznej. University of Innsbruck.
- « Przykłady przepisów dotyczących transferu ciepła, przykłady
- 15 Korzyści z jabłek na zdrowie fizyczne i psychiczne »

