Typy cyklooksygenazy, reakcja, inhibitory
- 2988
- 347
- Prokul Woliński
Cyklooksygenazy (COXS), znana również jako syntaza prostaglandyn H lub syntheza endoporoksydowa prostaglandyn, to enzymy kwasu tłuszczowego tlenowego, które należą do nadrodziny mieloperoksydazy i znalezione u wszystkich zwierząt kręgowców.
Cycoxygenazy to enzymy dwufunkcyjne, ponieważ mają dwie różne aktywności katalityczne: jedna aktywność cyklooksygenazy i jedna peroksydaza, które pozwalają im katalizować Bis-natlenienie i redukcja kwasu arachidonowego w celu utworzenia prostaglandyn.
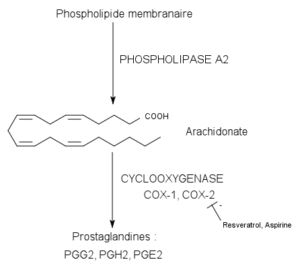 Katalizowana reakcja przez enzymy cykloksygenazy (źródło: PancRAT [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons)
Katalizowana reakcja przez enzymy cykloksygenazy (źródło: PancRAT [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons) Nie znaleziono ich w roślinach, owadach ani w organizmach jednokomórkowych, ale w komórkach kręgowców te enzym, pęcherzyki itp.
Pierwsze wykrycia produktów syntetyzowane przez cyklooksygenazy zostały wykonane w płynach nasiennych, więc początkowo sądzono, że to substancje wytwarzane w prostaty, dlatego nazywano je „prostaglandynami”.
Dzisiaj wiadomo, że prostaglandyny są syntetyzowane we wszystkich tkankach zwierząt kręgowców, a nawet w organizmach, które nie mają gruczołów prostaty, i że różne izomery tych cząsteczek mają różne funkcje w różnych procesach fizjologicznych i patologicznych, takich jak gorączka, wrażliwość na wrażliwość na gorączkę, wrażliwość na nacisk na gorączkę, wrażliwość na gorączkę, wrażliwość na gorączkę, wrażliwość na gorączkę, wrażliwość na gorączkę, Wrażliwość na ból lub algees, stan zapalny, zakrzepica, mitogeneza, rozszerzenie naczyń i zwężenie naczyń, owulacja. funkcja nerek itp.
[TOC]
Chłopaki
Zgłoszono istnienie dwóch rodzajów cyklooksygenaz między zwierzętami kręgowców. Pierwszy, który został odkryty i oczyszczony, jest znany jako Cox-1 lub po prostu Cox, i został po raz pierwszy oczyszczony w 1976 r. Z nasiennych pęcherzyków owce.
Drugą cykloksygenazą odkrytą wśród eukariotów była COX-2, w 1991 roku. Do tej pory udowodniono, że wszystkie zwierzęta kręgowców, w tym ryby chrzęstne, ryby kości, ptaki i ssaki, mają dwa geny kodujące enzymy cox.
Może ci służyć: krążenie grzybów: składniki odżywcze, substancje, osmoregulacjaJeden z nich, Cox-1, koduje cyklooksigenazę 1, która jest konstytutywna, podczas gdy gen COX-2 koduje indukowalną cyklooksygenazę.
Charakterystyka zarówno genów, jak i ich produktów enzymatycznych
Enzymy COX-1 i COX-2 są dość podobne, co jest rozumiane jako 60–65% podobieństwa między jego sekwencjami aminokwasowymi.
Geny Cox-1 Ortolodzy (geny z różnych gatunków, które mają to samo pochodzenie) we wszystkich gatunkach zwierząt kręgowców wytwarzają białka COX-1, które dzielą do 95% tożsamości ich sekwencji aminokwasowych, co jest również prawdziwe dla ortologów COX-2, których produkty mają od 70 do 90% tożsamości.
Cnidarianie i Ascidias mają również dwa geny Sternik, Ale różnią się one od innych zwierząt, więc niektórzy autorzy hipotezują, że geny te mogły pojawić się w niezależnych zdarzeniach powielania od tego samego wspólnego przodka.
Cox-1
Gen Sternik-1 waży około 22 kb i jest konstytutywnie wyrażany do kodowania białka COX-1, które przed przetworzeniem ma około 600 odpadów aminokwasowych, ponieważ ma hydrofobowy peptyd sygnał.
To białko znajduje się głównie w retikulum endoplazmatycznym, a jego ogólna struktura ma postać homodimera, to znaczy dwóch identycznych łańcuchów polipeptydowych, które są związane z tworzeniem aktywnego białka.
COX-2
Gen Sternik-2 Z drugiej strony waży około 8 kb, a jego ekspresja jest indukowana przez cytokiny, czynniki wzrostu i inne substancje. To koduje enzym COX-2, w tym peptyd sygnałowy, 604 odpady aminokwasowe i 581 po przetworzeniu.
Może ci służyć: oddech beztlenowyTen enzym jest również homodimeryczny i znajduje się między retikulum endoplazmatycznym a zapakowanym nuklearnym.
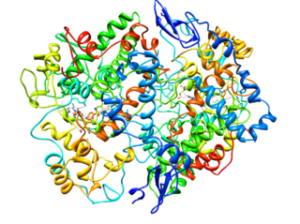 Struktura molekularna cykloksygenazy typu 2 (COX-2) (Źródło: cytochrom C na angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons)
Struktura molekularna cykloksygenazy typu 2 (COX-2) (Źródło: cytochrom C na angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons) Na podstawie analizy ich struktur ustalono, że enzyma COX-1 i COX-2 Naturmalny czynnik wzrostu).
W tym module znajdują się wyjątkowo zachowane wiązania disiarczkowe lub mosty, które działają jako „domena dimeryzacji” między dwoma polipeptydami każdego enzymu homodimerycznego.
Białka mają również amfipatyczne śmigiery, które ułatwiają zakotwiczenie do jednej z warstw błony. Ponadto domena katalityczna obu ma dwa aktywne miejsca, jedno z aktywnością cyklooksygenazy, a druga z aktywnością peroksydazy.
Oba enzymy są wyjątkowo zachowanymi białkami, ponieważ są wśród różnych gatunków niewielkie różnice w odniesieniu do mechanizmów dimeryzacji i unii wobec błony, a także pewne cechy ich domen katalitycznych.
Białka COX dodatkowo mają miejsca glikozylacji, które są niezbędne do ich działania i które są absolutnie zachowane.
Reakcja
Enzymy cykloksygenazy 1 i 2 są odpowiedzialne za katalizowanie pierwszych dwóch etapów biosyntezy prostaglandyny, które zaczynają się od konwersji kwasu arachidonowego w prekursory prostaglandyn znane jako hydroperoksydoporoksyd PGG2.
Aby te enzymy mogły wykonywać swoje funkcje, najpierw muszą być aktywowane przez proces zależny od aktywności peroksydazy. Innymi słowy, jego główna aktywność zależy od zmniejszenia substratu nadtlenku (za pośrednictwem aktywnego miejsca peroksydazy), tak że nastąpiło utlenianie żelaza związanego z grupą hemo, która służy jako kofaktor.
Może ci służyć: Monera Kingdom: Charakterystyka, klasyfikacja i przykładyUtlenianie grupy hemo powoduje tworzenie rodnika tyrozilu w aktywnej cyklooksygenazie, która aktywuje enzym i promuje inicjację reakcji cyklooksygenazy. Ta reakcja aktywacji może wystąpić tylko raz, ponieważ rodnik tyrozilu jest regenerowany podczas ostatniej reakcji trasy.
Inhibitory
Cyklooksygenazy biorą udział w syntezie prostaglandyn, które są hormonami z funkcjami w ochronie błony śluzowej jelit, w agregacji płytek krwi i regulacji czynności nerek, oprócz uczestnictwa w procesach zapalenia, bólu i gorączki i gorączki.
W związku z faktem, że enzymy te mają kluczowe znaczenie dla produkcji tych hormonów, szczególnie tych, które mają związek z procesami zapalnymi, liczne badania farmakologiczne koncentrowały się na hamowaniu cyklooksygenaz.
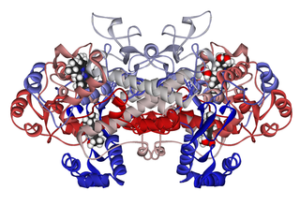 Struktura molekularna cykloksygenazy 1 powiązana z ibuprofenem (źródło: Fvasconcellos 5 maja 2007 r. [Domena publiczna] za pośrednictwem Wikimedia Commons)
Struktura molekularna cykloksygenazy 1 powiązana z ibuprofenem (źródło: Fvasconcellos 5 maja 2007 r. [Domena publiczna] za pośrednictwem Wikimedia Commons) W ten sposób wykazano, że mechanizm działania wielu niesteroidalnych leków przeciwzapalnych ma związek z nieodwracalną lub odwracalną (hamującą) acetylacją cyklooksigenazy w te enzymie.
Wśród tych leków są piroxicam, ibuprofen, aspiryna, flurbiprofen, diklofenak, naproksen i inne.
Bibliografia
- Botting, r. M. (2006). Inhibitory cyklooksygenaz: mechanizmy, selektywność i zastosowania. Journal of Physiology and Pharmacology, 57, 113.
- Chandrasekharan, n. V., & Simmons, D. L. (2004). Cyklooksygenazy. Genome Biology, 5 (9), 241.
- Fitzpatrick, f. DO. (2004). Enzymy cyklooksygenazy: regulacja i funkcja. Obecny projekt farmaceutyczny, 10 (6), 577-588.
- Kundu, n., Smyth, m. J., Samsel, L., & Fulton, do. M. (2002). Inhibitory cyklooksygenazy blokują wzrost komórek, zwiększa ceramid i hamują cykl komórkowy. Badania i leczenie raka piersi, 76 (1), 57-64.
- Rauzer, c. DO., & Marnett, L. J. (2009). Cyklooksygenazy: spostrzeżenia strukturalne i funkcjonalne. Journal of Lipid Research, 50 (suplement), S29-S34.
- Vane, J. R., Bakhle i. S., & Botting, r. M. (1998). Cycloooksygenses 1 i 2. Coroczny przegląd farmakologii i toksykologii, 38 (1), 97-120.

