Struktura, właściwości, synteza i zastosowania cykloheksu

- 1164
- 309
- Herbert Wróblewski
On Cyclohexen Jest to alken lub cykliczna olefina, której wzór molekularny wynosi c6H10. Składa się z bezbarwnego płynu, nierozpuszczalnego w wodzie i mieszczalnych z wieloma rozpuszczalnikami organicznymi. Charakteryzuje się łatwopalnym i w naturze zwykle występuje w Hulla Tar.
Cykloheksen jest syntetyzowany przez częściowe uwodornienie benzenu i odwodnienie alkoholu cykloheksanolowego; to znaczy bardziej utleniony sposób. Podobnie jak inne cykloalqueny, doświadcza elektrofilowego dodawania i wolnych rodników; Na przykład reakcja halogenowa.
 Cząsteczka cykloheksenu. Źródło: Neuropoger.
Cząsteczka cykloheksenu. Źródło: Neuropoger. Ten cykliczny (górny obraz) tworzy mieszaniny Aceotropowe (nie można się rozdzielić przez destylację), z niższymi alkoholem i kwasem octowym. Nie jest bardzo stabilny w długotrwałym przechowywaniu, ponieważ rozkłada się pod działaniem światła słonecznego i promieniowania ultrafioletowego.
Cykloheksen jest używany jako rozpuszczalnik, a zatem ma liczne zastosowania, takie jak: wysoko oktanowa stabilizator benzyny i ekstrakcja oleju.
Ale najważniejsze jest to, że cykloheksen służy jako pośrednik i surowiec w celu uzyskania licznych związków o dużej użyteczności, w tym: cykloheksanonu, kwasu tłuszczowego, kwasu maleinowego, cykloheksanu, butenen, butenen, cykloheksylokboksylowego kwasu itp.
[TOC]
Struktura cykloheksenu
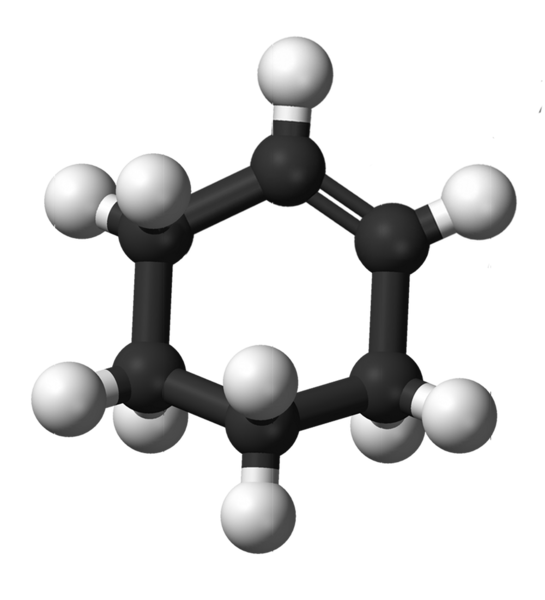 Struktura cykloheksenu. Źródło: Kemikungen [domena publiczna]
Struktura cykloheksenu. Źródło: Kemikungen [domena publiczna] Górny obraz pokazuje strukturę cykloheksenu z modelem sfer i słupków. Możesz zauważyć pierścień sześciu węglowych i podwójne wiązanie, zarówno nienasycenie związku. Z tej perspektywy wydaje się, że pierścień jest płaski; Ale wcale nie jest.
Na początek węgle z podwójnym wiązaniem mają hybrydyzację SP2, co daje im płaską geometrię trygonalną. Dlatego te dwa węgle i przylegające do nich znajdują się w tej samej płaszczyźnie; podczas gdy dwa węgle na przeciwległym końcu (do podwójnego wiązania), są powyżej i pod wspomnianym płaszczyzną.
Może ci służyć: ciężkość właściwaGorszy obraz doskonale ilustruje nowo wyjaśnione.
 Widok przedniej struktury cykloheksowej. Źródło: Ben Mills.
Widok przedniej struktury cykloheksowej. Źródło: Ben Mills. Zauważ, że czarny pasek składa się z czterech węgli: dwóch podwójnych więzi, a pozostałe sąsiadujące z nimi. Odsłonięta perspektywa to ta, która zostałaby uzyskana, gdyby widz postawił oko tuż przed podwójnym ogniwem. Można zatem zauważyć, że węgiel jest w górę i pod tą płaszczyzną.
Ponieważ cząsteczka cykloheksenu nie jest statyczna, dwa węgle zostaną wymienione: jeden zejdzie na dół. Tak więc można się zachować tę cząsteczkę.
Interakcje międzycząsteczkowe
Cykloheksen jest węglowodorem, a zatem jego interakcje międzycząsteczkowe są oparte na Londynie siły dyspersji.
Wynika to z faktu, że cząsteczka jest apolarna, bez stałego dipolu, a jej masa cząsteczkowa jest czynnikiem, który najbardziej przyczynia się do utrzymania jej spójności w cieczy.
Podobnie, podwójne wiązanie zwiększa stopień interakcji, ponieważ nie może poruszać się z taką samą elastycznością jak w przypadku innych węgli, co sprzyja interakcji między sąsiadującymi cząsteczkami. Z tego powodu cykloheksen ma nieco większą temperaturę wrzenia (83ºC) niż cykloheksan (81ºC).
Nieruchomości
Nazwy chemiczne
Cyclohexen, tetrahydribenzen.
Waga molekularna
82 146 g/mol.
Wygląd fizyczny
Bezbarwny płyn.
Zapach
Słodki zapach.
Punkt wrzenia
83 ºC do 760 mmHg.
Temperatura topnienia
-103,5 ° C.
punkt zapłonu
-7 ºC (zamknięty kubek).
Rozpuszczalność wody
Praktycznie nierozpuszczalne (213 mg/l).
Rozpuszczalność w rozpuszczalnikach organicznych
Mamiczne z etanolem, benzenem, tetrachlorkiem węglowym, eterem olejowym i acetonem. Oczekuje się, że będzie w stanie rozpuścić związki apolarne, takie jak niektóre alotropy węgla.
Może ci służyć: Torio: Struktura, właściwości, uzyskiwanie, użyciaGęstość
0,810 g/cm3 w 20ºC.
Gęstość pary
2,8 (z relacją powietrza uznaną za równą 1).
Ciśnienie pary
89 mmHg w 25ºC.
Samokierunek
244 ° C.
Rozkład
Rozkłada się w obecności soli uranu, pod działaniem światła słonecznego i promieniowania ultrafioletowego.
Breja
0,625 mpascal w 25 ° C.
Ciepło spalania
3.751,7 kJ/mol w 25 ° C.
Ciepło parowe
30,46 kJ/mol w 25 ° C.
Napięcie powierzchniowe
26,26 MN/M.
Polimeryzacja
Może polimeryzować w określonych warunkach.
Zapach próg
0,6 mg/m3.
Współczynnik załamania światła
1 4465 do 20 ° C.
Ph
7-8 do 20ºC.
Stabilność
Cyclohexen nie jest bardzo stabilny podczas długoterminowego przechowywania. Ekspozycja na światło i powietrze może powodować produkcję nadtlenków. Jest również niezgodny z silnymi środkami utleniającymi.
Reakcje
-Cykloalki głównie doświadczają reakcji dodawania, zarówno elektrofilowych, jak i wolnych rodników.
-Reaguje z bromem, tworząc 1,2-dibromocykloheksan.
-Szybko utlenia się w obecności permangananu potasu (KMNO4).
-Jest w stanie wytwarzać epoksyd (tlenek cykloheksen) w obecności kwasu peroksybenzoesowego.
Synteza
Cykloheksen jest wytwarzany przez katalizę kwasu cykloheksanolowego:
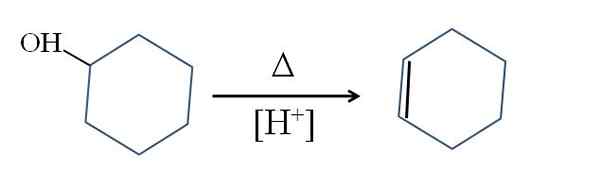 Odwodnienie cykloheksanolu. Źródło: Gabriel Bolívar.
Odwodnienie cykloheksanolu. Źródło: Gabriel Bolívar. Symbol δ reprezentuje ciepło niezbędne do promowania wyjściowej grupy OH jako cząsteczki wody w kwaśnej pożywce (-OH2+).
Cykloheksen występuje również przez częściowe uwodornienie benzenu; Oznacza to, że dwa z podwójnych wiązań dodają cząsteczki wodoru:
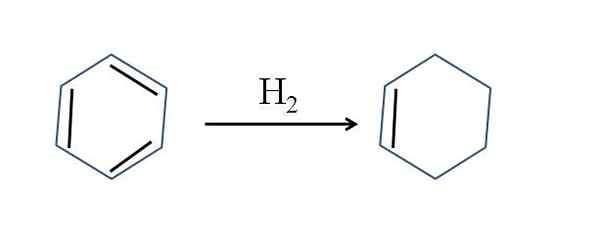 Częściowe uwodornienie benzenu. Źródło: Gabriel Bolívar.
Częściowe uwodornienie benzenu. Źródło: Gabriel Bolívar. Chociaż reakcja wydaje się prosta, wymaga wielkiego h2 i katalizatory.
Aplikacje
-Ma użyteczność jako organiczny rozpuszczalnik. Ponadto jest to surowiec do wytwarzania kwasu tłuszczowego, aldehydu tłuszczowego, kwasu maleinowego, cykloheksanu i kwasu cykloheksylokboksylowego.
Może ci służyć: radioaktywność-Jest stosowany w produkcji chlorku cykloheksanu, związku stosowanego jako pośrednik przygotowania produktów farmaceutyczny.
-Cykloheksen jest również stosowany w syntezie cykloheksanonu, surowca do produkcji leków, pestycydów, perfum i barwników.
-Cykloheksen interweniuje w syntezie aminocykloheksanolu, związku, który jest stosowany jako środek powierzchniowo czynny i emulgator.
-Ponadto Cykloheksen można wykorzystać do przygotowania w laboratorium Butadieno. Ten ostatni związek jest stosowany w produkcji gumy syntetycznej, w opracowaniu opon samochodowych, a także jest stosowany w opracowaniu plastików akrylowych.
-Cykloheksen jest surowcem do syntezy lizyny, fenolu, żywicy polikloolefiny i dodatków gumowych.
-Jest stosowany jako stabilizator benzyn o wysokiej oktanowej.
-Interweniuje w syntezie wodoodpornych powłok, folii odpornych na pęknięcia i foldery wiążące do powłok.
Ryzyko
Cykloheksen nie jest bardzo toksycznym związkiem, ale może powodować, że kontaktuje się zaczerwieniem skóry i oczu. Jego wdychanie może powodować kaszel i senność. Ponadto jego spożycie może powodować senność, trudności z oddychaniem i nudnościami.
Cykloheksen jest mało wchłaniany w przewodzie pokarmowym, więc nie oczekuje się poważnych efektów ogólnoustrojowych ze względu na jego spożycie. Maksymalne powikłanie to jego aspiracja do układu oddechowego, który może wytwarzać chemiczne zapalenie płuc.
Bibliografia
- Joseph f. Chiang i Simon Harvey Bauer. (1968). Struktura molekularna cykloheksenu. J. JESTEM. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cykloheksen: zagrożenia, synteza i struktura. Badanie. Odzyskane z: Study.com
- Morrison, r. T. I Boyd, r. N. (1987). Chemia organiczna. (5ta Wydanie.). Redakcja Addison-Wesley Iberoamericana.
- Pubchem. (2019). Cykloheksen. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Książka chemiczna. (2019). Cykloheksen. Odzyskany z: chemicalbook.com
- Sieć danych toksykologii. (2017). Cykloheksen. Toxnet. Odzyskane z: toksnet.NLM.Nih.Gov
- Chemoksy. (S.F.). Formuła strukturalna dla cykloheksenu wynosi. Odzyskane z: chemoksy.com

