Komórki elektrochemiczne

- 1357
- 39
- Prokul Woliński
Jakie są komórki elektrochemiczne?
Komórki elektrochemiczne Są to urządzenia, w których przechodzą reakcje chemiczne, w których energia chemiczna jest przekształcana w energię elektryczną lub odwrotnie. Komórki te stanowią serce elektrochemii, dusza jest potencjalną wymianą elektronów, które mogą wystąpić, spontaniczne lub nie spontanicznie, między dwoma gatunkami chemicznymi.
Jeden z dwóch gatunków utlenia się, traci elektrony, a drugi jest zmniejszony przez wygranie Ceded Electrons. Zwykle gatunek, który jest zmniejszony, jest metalicznym kationem w roztworze, który dzięki elektrycznemu zdobyciu elektrycznego elektrody wykonanej z tego samego metalu. Z drugiej strony gatunek utleniający się jest metalem, stając się metalowymi kationami.
 Elektrochemiczny schemat komórek Daniela. Źródło: Rechua [CC przez (https: // creativeCommons.Org/licencje/według/3.0)]
Elektrochemiczny schemat komórek Daniela. Źródło: Rechua [CC przez (https: // creativeCommons.Org/licencje/według/3.0)] Na przykład doskonały obraz reprezentuje komórkę Daniela: najprostszy ze wszystkich komórek elektrochemicznych. Metaliczna elektroda cynkowa jest utleniona, uwalniając kationów Zn2+ do środowiska wodnego. Dzieje się tak w pojemniku Znso4 z lewej.
Po prawej rozwiązanie zawierające CUO4 Jest zmniejszony, przekształcając kationy cu2+ W metalicznej miedzi osadzonej na elektrodzie miedzianej. Podczas opracowywania tej reakcji elektrony przemieszczają obwód zewnętrzny aktywując ich mechanizmy; A zatem zapewnienie energii elektrycznej do działania sprzętu.
Elektrochemiczne elementy komórkowe
Elektrody
W komórkach elektrochemicznych są generowane lub spożywane. Aby zapewnić prawidłowy przepływ elektronów, muszą istnieć materiały, które są dobrym przewodnikiem energii elektrycznej. Tutaj pojawiają się elektrody i obwód zewnętrzny, wyposażone w okablowanie miedziane, srebrne lub złoto.
Elektrody to materiały, które zapewniają powierzchnię, na której powstają reakcje w komórkach elektrochemicznych. Istnieją dwa typy zgodnie z reakcją, która występuje w nich:
- Anoda, elektroda, w której występuje utlenianie.
- Katoda, elektroda, w której występuje redukcja.
Elektrody mogą być wykonane z materiału reagującego, jak w przypadku komórki Daniela (cynk i miedź); lub z materiału obojętnego, jak ma to miejsce w przypadku platyny lub grafitu.
Elektrony przypisane przez anodę muszą dotrzeć do katody; Ale nie przez rozwiązanie, ale podróżowanie metalicznym kablem, który łączy oba elektrody do obwodu zewnętrznego.
Rozpuszczanie elektrolitów
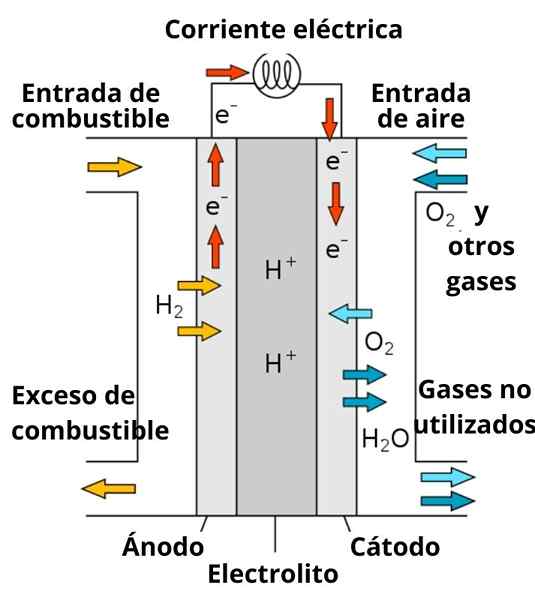 Schemat akumulatora paliwa przewodzącego protony
Schemat akumulatora paliwa przewodzącego protony Rozwiązanie otaczające elektrody odgrywa również ważną rolę, ponieważ jest wzbogacona o silne elektrolity; takie jak: kcl, kno3, NaCl itp. Jony te faworyzują w pewnym stopniu migracja elektronów z anody do katody, a także ich przewodzenie przez okolicę elektrod w celu interakcji z gatunkiem w celu zmniejszenia.
Na przykład woda morska prowadzi znacznie lepszą elektryczność niż woda destylowana, z niższym stężeniem jonów. Dlatego komórki elektrochemiczne mają roztwór silnych elektrolitów wśród ich składników.
Most soli
Jony roztworu zaczynają otaczać elektrody powodujące polaryzację obciążeń. Rozpadek wokół katody zaczyna ładować negatywnie, ponieważ kationowie są zmniejszone; W przypadku komórki Daniela, kationów CU2+ Zdeponując jako metaliczną miedź na katodzie. Zatem istnieje deficyt pozytywnych zarzutów.
Tutaj interweniuje most soli fizjologicznej, aby zrównoważyć obciążenia i zapobiec spolaryzacji elektrod. Z boku lub przedział katalogu mostu soli fizjologicznego migruje się, albo k+ lub Zn2+, Aby zastąpić Cu2+ strawiony. Tymczasem z mostu solnego nie migruje anionów3- W kierunku przedziału anody, w celu zneutralizowania rosnącego stężenia kationów Zn2+.
Może ci służyć: dichrominian potasu: wzór, właściwości, ryzyko i zastosowaniaMostka solkowa składa się z nasyconego roztworu soli, z jego końcami pokrytymi przepuszczalnym żelem jonowym, ale wodoodpornym do wody.
Rodzaje komórek elektrochemicznych i sposób, w jaki działają
Sposób, w jaki działa komórka elektrochemiczna, zależy od typu. Istnieją zasadniczo dwa typy: galwaniczny (lub woltowy) i elektrolityczny
Galvanics
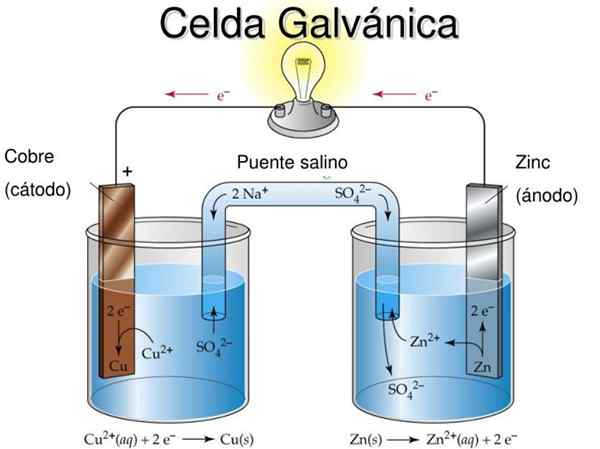
Komórka Daniela jest przykładem galwanicznej komórki elektrochemii. W nich reakcje występują spontanicznie, a potencjał baterii jest dodatni; Im większy potencjał, tym większa energia elektryczna, która dostarczy komórkę.
Akumulatory lub akumulatory są dokładnie ogniwami galwanicznymi: potencjał chemiczny między dwiema elektrodami przekształca się w energię elektryczną, gdy łączy obwód zewnętrzny, który je łączy. W ten sposób elektrony migrują z anody, rozświetl sprzęt, do którego bateria jest podłączona i są zwracane bezpośrednio do katody.
Elektrolityczny
Komórki elektrolityczne to te, których reakcje nie występują spontanicznie, chyba że są one dostarczane energią elektryczną ze źródła zewnętrznego. Tutaj występuje odwrotne zjawisko: energia elektryczna pozwala na rozwój niespontanicznych reakcji chemicznych.
Jedną z najbardziej znanych i cennych reakcji, które zachodzą w obrębie tego typu ogniwa, jest elektroliza.
Baterie do ładowania są przykładami elektrolitycznych, a jednocześnie galwanika: są one naładowane w celu odwrócenia reakcji chemicznych i przywrócenia początkowych warunków ponownego użycia ponownego użycia.
Przykłady
Komórka Daniela
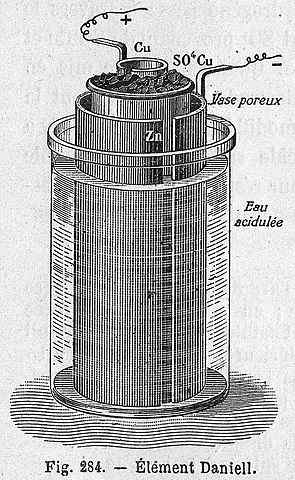 Schemat komórki Daniela
Schemat komórki Daniela Poniższe równanie chemiczne odpowiada reakcji komórki Daniela, w której uczestniczy cynk i miedź:
Może ci służyć: wynajem halogenurus: właściwości, uzyskiwanie przykładówZn (s) + cu2+(aq) → Zn2+(aq) + cu (s)
Ale kationów CU2+ i Zn2+ Nie są sami, ale towarzyszą im SO Aniony42-. Ta komórka może być reprezentowana w następujący sposób:
Zn | Znso4 |. |. Cuso4 |. Cu
Komórka Daniela może być zbudowana w każdym laboratorium, ponieważ jest bardzo powtarzającą się jako praktyka we wprowadzaniu elektrochemii. Jako cu2+ Jest osadzony jako Cu, niebieski kolor roztworu CUSO4 Zostanie zgubiony.
Komórka platynowa i wodorowa
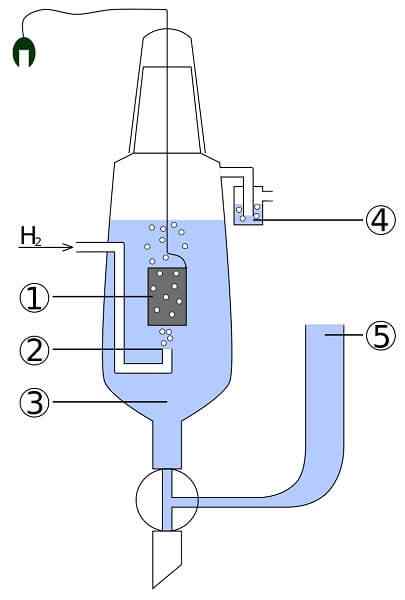 Schemat komórki platyny i wodoru: 1. 2 Elektrodę platynową. Gaz wodoru 3. Roztwór kwasowy 4. Hidroseal 5. Depozyt związkowy
Schemat komórki platyny i wodoru: 1. 2 Elektrodę platynową. Gaz wodoru 3. Roztwór kwasowy 4. Hidroseal 5. Depozyt związkowy Wyobraź sobie komórkę, która zużywa gazowy wodór, wytwarza metalowe srebro, a jednocześnie przyjmuje energię elektryczną. Jest to komórka platyny i wodoru, a jej ogólna reakcja jest następująca:
2Agcl (s) + h2(g) → 2ag (s) + 2h+ + 2cl-
Tutaj, w przedziale anody mamy obojętną elektrodę platynową, zanurzoną w wodzie i do której pompowany wodór gazowy. H2 Utleniaj się do H+ i daje swoje elektrony do mlecznego osadu AGCL w przedziale katodowym z metalową srebrną elektrodą. AGCL zostanie zmniejszone na tym srebrze, a ciasto elektrodowe wzrośnie.
Ta komórka może być reprezentowana jako:
Pt, h2 |. H+ |. |. Cl-, AGCL | Ag
Komórka Downs
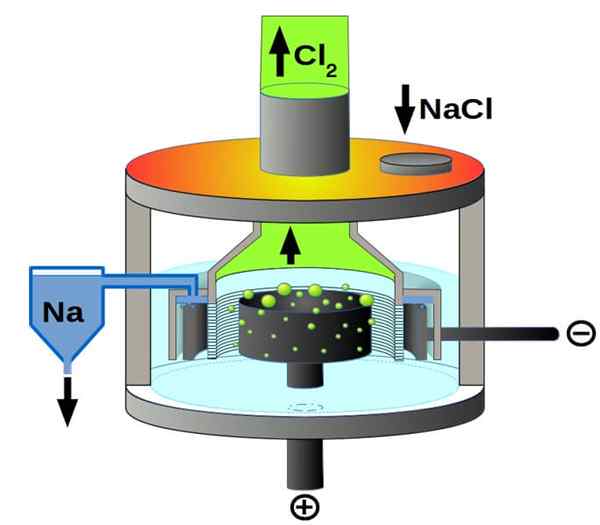 Schemat komórek Downs do elektrolizy chlorku sodu. Źródło: Pchemiker, CC BY-SA 4.0, Via Wikimedia Commons
Schemat komórek Downs do elektrolizy chlorku sodu. Źródło: Pchemiker, CC BY-SA 4.0, Via Wikimedia Commons I wreszcie, wśród komórek elektrolitycznych mamy stopiony chlorek sodu, lepiej znany jako komórka Downs. Tutaj prąd jest wytwarzany przez elektrody objętość stopionego NaCl, a zatem pochodzi z nich następujące reakcje:
2+(l) + 2e- → 2na (s) (katoda)
2cl-(L) → Cl2(g) + 2e- (anoda)
2NACL (L) → 2NA (s) + Cl2(g) (reakcja globalna)
Zatem dzięki elektryczności i chlorku sodu można przygotować metaliczny gaz sodu i chloru.

