Części komórek galwanicznych, jak działa, aplikacje, przykłady

- 4534
- 606
- Arkady Sawicki
Komórka galwaniczna Komórka wooltaiczna jest rodzajem komórek elektrochemicznych, która składa się z dwóch różnych metali zanurzonych w dwóch półprzewodnikach, w których związek w aktywnym roztworze jest reakcją spontaniczną.
Następnie jeden z metali w jednym z półprzewodników jest utleniony, podczas gdy metal drugiego półproduktu jest zmniejszony, wytwarzając wymianę elektronów przez obwód zewnętrzny. To pozwala skorzystać z prądu elektrycznego.
 Rysunek 1. Schemat i części komórki galwanicznej. Źródło: Korynta.PUCP.Edu.pe.
Rysunek 1. Schemat i części komórki galwanicznej. Źródło: Korynta.PUCP.Edu.pe. Nazwa „Galvanic Cell” jest na cześć jednego z pionierów eksperymentów z elektrycznością: włoski lekarz i fizjolog Luigi Galvani (1737-1798).
Galvani odkrył w 1780 roku, że jeśli dołączyły one jedno końcowe kable różnych metali, a wolne końce zostały skontaktowane z ANCA żaby (martwej), nastąpił skurcz.
Jednak pierwszym, który zbudował komórkę elektrochemii w celu wytwarzania energii elektrycznej, była również włoska alessandro volta (1745–1827) w 1800 r., A zatem alternatywna nazwa ogniwa woltowego.
Części komórki galwanicznej
Części komórki galwanicznej pokazano na rycinie 1 i są następujące:
1.- Anodic Semi -Media
2.- Elektroda anodowa
3.- Rozwiązanie anodowe
4.- Katodic Semi -Media
5.- Elektroda katodowa
6.- Rozwiązanie katodowe
7.- Most soli
8.- Metalowy przewodnik
9.- Woltometr
Funkcjonowanie
Aby wyjaśnić funkcjonowanie komórki galwanicznej, będziemy polegać na niższej:
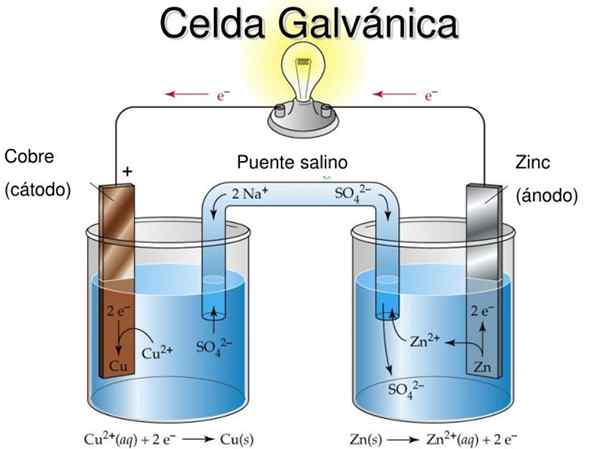 Rysunek 2. Model dydaktyczny komórki galwanicznej. Źródło: Slideserve.com
Rysunek 2. Model dydaktyczny komórki galwanicznej. Źródło: Slideserve.com Podstawową ideą ogniwa galwanicznego jest to, że metal doznany przez reakcję utleniania jest fizycznie oddzielona od metalu, który jest zmniejszony, tak że wymiana elektronów zachodzi przez przewodnik zewnętrzny, który pozwala skorzystać z przepływu prądu elektrycznego , Na przykład oświetlenie żarówki lub diody LED.
Na rycinie 2 w półmedii po lewej stronie masz metaliczną taśmę miedzi (Cu) zanurzoną w roztworze siarczanu miedzi (CUS04), Podczas gdy w prawej pół -liści znajduje się taśma cynkowa (Zn) zanurzona w roztworze siarczanu cynku (Znso4).
Należy zauważyć, że w każdym półprodukcie metal każdego z nich jest obecny w dwóch stanach utleniania: neutralnych atomów metalu i jonów metali soli tego samego metalu w roztworze.
Jeśli metalowe taśmy nie są połączone przez zewnętrzny kabel przewodzący, wówczas oba metale utleniają się osobno w odpowiednich komórkach.
Jednak gdy jest podłączony elektrycznie, utlenianie nastąpi w Zn, podczas gdy nastąpi reakcja redukcji w Cu. Wynika to z faktu, że stopień utleniania cynku jest większy niż stopień miedzi.
Metal, który utlenia plony do metalu zmniejszonego przez przewód zewnętrzny i ten przepływ prądu można zastosować.
Może ci służyć: halogeniczne pochodneReakcje utleniania i redukcji
Reakcja występująca po prawej stronie między elektrodą metalu cynku a wodnym roztworem siarczanu cynku jest następująca:
Znalbo(S) + Zn2+ (POŁUDNIOWY ZACHÓD4)2- → 2 Zn2+(AC) + (POŁUDNIOWY ZACHÓD4)2- + 2 e-
Atom cynku (stałego) na powierzchni elektrody anodowej w pół -prawicy prawej, stymulowanej przez dodatnie jony cynku w roztworze, daje dwa elektrony i wyłania się z elektrody, przechodząc do roztworu wodnego roztworu wodnego jako dodatni podwójny jon cynku.
Zdaliśmy sobie sprawę, że wynik netto polegał na tym, że atom neutralnego metalu cynku, utraty dwóch elektronów, stał się jonem cynku, który dodaje do roztworu wodnego, tak że pasek cynku stracił atom, a roztwór nabył dodatni podwójny jon jonowy.
Wyzwolone elektrony wolą poruszać się przez kabel zewnętrzny w kierunku metalu drugiego półmedia z dodatnim obciążeniem (Cartodo +). Pasek cynku traci masę, ponieważ jego atomy stopniowo przechodzą do roztworu wodnego.
Utlenianie cynku można podsumować w następujący sposób:
Znalbo(S) → Zn2+(AC) + 2 e-
Reakcja występująca po lewej stronie jest podobna, ale miedź roztworu wodnego oddaje dwa elektrony (pochodzące z drugiego półtenu) i jest osadzona w elektrodzie miedzianej. Kiedy atom przechwytuje elektrony, mówi się, że został zmniejszony.
Reakcja redukcji miedzi jest napisana w ten sposób:
Cu2+(AC) + 2 e- → Cualbo(S)
Miedziany pasek zyskuje ciasto, ponieważ jony roztworu przechodzą do baru.
Utlenianie występuje w anodzie (ujemnej), która odpycha elektrony, podczas gdy redukcja występuje w katodzie (dodatnie), która przyciąga elektrony. Wymiana elektronów odbywa się za pośrednictwem sterownika zewnętrznego.
Most soli
Most soli fizjologicznej równoważy obciążenia, które kumulują się w dwóch półchodach. W anodowych pół -diadu kumulują się jony dodatnie.
W przypadku mostu soli fizjologicznego stosuje się roztwór soli (taki jak chlorek sodu lub chlorek potasowy), który nie interweniuje w reakcji, która znajduje się w odwróconej rurce w kształcie U, z końcami podłączonymi ścianą porowatego materiału.
Jedynym celem mostu soli fizjologicznego jest filtrowanie jonów do każdego równoważenia lub neutralizowania nadmiaru komórki. Zatem przez mostek solny występuje przepływ prądu przez jony soli fizjologiczne, który zamyka obwód elektryczny.
Potencjały utleniania i redukcji
Rozumie się standardowe potencjały utleniania i redukcji.
Może ci służyć: Scandio: History, właściwości, reakcje, ryzyko i zastosowaniaDla cynku jego standardowy potencjał utleniania jestwół = +0,76 v. Tymczasem standardowy potencjał redukcji miedzi jest isiatka = +0,34 v. Siła elektromotoryczna (FEM) wytwarzana przez tę komórkę galwaniczną wynosi: FES = +0,76 V + 0,34 V = 1,1 V.
Globalną reakcję komórki galwanicznej można zapisać w ten sposób:
Znalbo(S) + Cu2+(AC) → Zn2+(AC) + Cualbo(S)
Biorąc pod uwagę siarczan, reakcja netto wynosi:
Znalbo(S) + Cu2+ (POŁUDNIOWY ZACHÓD4)2- 25ºC → Zn2+ (POŁUDNIOWY ZACHÓD4)2-+ Cualbo(S)
Siarczan jest widzem, a metale wymieniają elektrony.
Symboliczna reprezentacja komórki galwanicznej
Komórka galwaniczna na ryc. 2 jest symbolicznie reprezentowana w następujący sposób:
Znalbo(S)| Zn2+(AC) (1m) || Cu2+(AC) (1m) | cualbo(S)
Zgodnie z konwencją, po lewej stronie metal, który utlenia się i tworzy anodę (-) i oddzielony przez pręt (|) jej jon w stanie wodnym jest zawsze umieszczany. Anodic Semi -Medium jest oddzielone od katodu dwoma prętami (||), które reprezentują most soli fizjologicznej. Po prawej, metalowy półmedium, który jest zmniejszony i tworzy katodę (+).
W symbolicznej reprezentacji komórki galwanicznej koniec jest zawsze metal, który utlenia się, a na końcu metal jest umieszczony (w stanie stałym), który jest zmniejszony. Należy zauważyć, że na rycinie 2 półcele są odwrotne w odniesieniu do konwencjonalnej reprezentacji symbolicznej.
Aplikacje
Znane standardowe potencjały utleniania różnych metali, możliwe jest określenie siły elektromotorycznej, która wytworzy stos galwaniczny zbudowany z tymi metali.
W tej sekcji powyższe będzie miało zastosowanie w poprzednich sekcjach, aby obliczyć siłę elektromotoryczną netto komórki zbudowaną z innych metali.
Jako przykład zastosowania rozważamy galwaniczną komórkę żelaza (wiara) i miedzi (Cu). Jako dane podano następujące reakcje redukcji i jej standardowy potencjał redukcji, to znaczy w stężeniu 25ºC i 1m:
Wiara2+(AC) + 2 e- → Wiara(S). E1siatka = -0,44 v
Cu2+(AC) + 2 e- → Cu(S). E2siatka = +0,34 v
Poproszono o znalezienie siły elektromotorycznej netto wytwarzanej przez następujące ogniwo galwaniczne:
Wiara(S)| Wiara2+(AC)(1m) || cu2+(AC)| Cu(S)
Na tym stosie żelazo utlenia się i jest anodą komórki galwanicznej, podczas gdy miedź jest zmniejszona i jest katodą. Potencjał utleniania żelaza jest taki sam, ale w przeciwieństwie do jego potencjału redukcji, to znaczy E1OXD = +0,44.
Aby uzyskać siłę elektromotoryczną wytwarzaną przez tę komórkę galwaniczną, dodajemy potencjał utleniania żelaza z potencjałem redukcji miedzi:
Może ci służyć: tlenki azotu (NOX)fem = e1OXD + E2siatka = -E1siatka + E2siatka = 0,44 V + 0,34 v = 0,78 V.
Komórka galwaniczna w życiu codziennym
Komórki galwaniczne do codziennego użytku są dalekie od formy stosowanej jako model dydaktyczny, ale ich zasada działania jest taka sama.
Najczęstszym użyciem ogniwa jest bateria alkaliczna 1,5 V w różnych prezentacjach. Pierwsze imię pojawia się, ponieważ jest to zestaw komórek połączonych szeregowo w celu zwiększenia MES.
Akumulatory litowe są również oparte na tej samej zasadzie działania ogniw galwanicznych i są używane w smartfonach, zegarkach i innych urządzeniach.
W ten sam sposób wiodące akumulatory samochodów, motocykli i łodzi wynoszą 12 V i oparte są na tej samej zasadzie działania komórki galwanicznej.
Komórki galwaniczne są stosowane w estetyce i regeneracji mięśni. Istnieją zabiegi twarzy, które składają się z nakładania prądu przez dwie elektrody w postaci wałka lub kuli, które czyszczą i tonizują skórę.
Obecne impulsy mają również zastosowanie do regeneracji mięśni u osób, które są w stanie pokłony.
Budowa domowej roboty galwanicznej
Istnieje wiele sposobów na zbudowanie domowej roboty galwanicznej komórki. Jednym z najprostszych jest użycie octu jako roztworu, stalowych paznokci i miedzianych kabli.
Materiały
-Wyjątkowe naczynia z tworzywa sztucznego
-biały ocet
-Dwie śruby stalowe
-Dwa kawałki nagiego drutu miedzianego (bez izolacji lub lakieru)
-Woltometr
Procedura
-Wypełnij ¾ części szkła octem.
-Dołącz do dwóch stalowych śrub z kilkoma zakrętami drutu, pozostawiając kawałek drutu bez uzwojenia.
Niekończący się koniec miedzianego kabla jest składany w odwróconym kształcie U.
 Rysunek 3. Domowa komórka galwaniczna i multimetr. Źródło: YouTube.com
Rysunek 3. Domowa komórka galwaniczna i multimetr. Źródło: YouTube.com Kolejny kawałek miedzianego kabla jest również złożony w odwrócony i wisi na krawędzi szkła w diametralnie przeciwnej pozycji do zanurzonych śrub, tak że jedna część miedzi znajduje szkło.
Wolne końce kabli woltomierzy są podłączone do pomiaru siły elektromotorycznej wytwarzanej przez tę prostą komórkę. MES tego typu komórki wynosi 0,5 V. Aby dopasować MES z baterii alkalicznej, konieczne jest zbudowanie dwóch kolejnych ogniw i dołączenie do trzech w szeregu, aby uzyskać akumulator 1,5 V
Bibliografia
- Borneo, r. Komórki galwaniczne i elektrolityczne. Pobrano z: Quimica Classes.Blogspot.com
- Cedrón, j. Chemia ogólna. PUCP. Odzyskany z: Korynta.PUCP.Edu.pe
- Farrera, L. Wprowadzenie do elektrochemii. Departament fizykochemii UNAM. Odzyskane z: depa.Fquim.Unam.MX.
- Wikipedia. Komórka elektrochemiczna. Odzyskane z: jest.Wikipedia.com.
- Wikipedia. Komórka galwaniczna. Odzyskane z: jest.Wikipedia.com.

