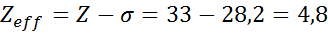Skuteczne obciążenie jądrowe
- 3539
- 895
- Filip Augustyn
Co to jest skuteczne obciążenie jądrowe?
Skuteczne obciążenie jądrowe (reprezentowane jako ZEff A w niektórych przypadkach jak Z*) Jest to obciążenie jądrowe netto, którego doświadcza elektron, gdy znajduje się w atomie wielokrzestronnym (to znaczy ma więcej niż jeden elektron).
W bardziej precyzyjny sposób, to ładunek elektryczny miałby rdzeń hipotetycznego atomu, który może przyciągnąć jedyny elektron z tą samą siłą, z jaką rdzeń prawdziwego atomu przyciąga ten sam elektron w obecności wszystkich innych elektronów.
Jest to skorygowane obciążenie jądrowe, które uwzględnia wpływ obecności innych elektronów na atom polilectroniczny. To zmniejszone obciążenie wyjaśnia, dlaczego najbardziej zewnętrzne elektrony w atomie wielobiętej są słabnie powiązane z jądrem niż elektronami wewnętrznymi.
Skuteczne obciążenie jądrowe jest pojęciem o wielkim znaczeniu w chemii, ponieważ pozwala nam zrozumieć okresową tendencję wielu właściwości, takich jak promień atomowy, promień jonowy, elektroonywność, energie jonizacyjne i więcej.
Dlaczego istnieje efektywne obciążenie jądrowe?
Skuteczne obciążenie jądrowe wynika z dwóch zjawisk:
- Wpływ ekranowania elektronów na atomy wielostrzeżowe.
- Odpychanie elektrostatyczne wśród elektronów, ponieważ każdy ma ten sam ładunek elektryczny.
On Efekt ekranowania Składa się z rodzaju tarczy utworzonej przez wewnętrzne elektronach atomu, który obejmuje jądro. To sprawia, że najbardziej zewnętrzne elektrony „odczuwają” niższe przyciąganie jądra, niż byłyby to, gdyby inne elektrony nie były obecne.
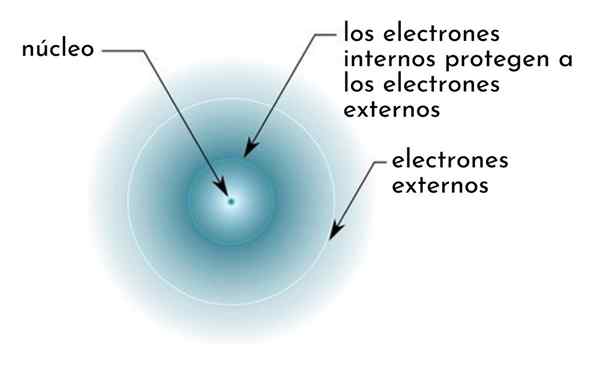 Rysunek schematycznie pokazujący wewnętrzne elektrony działające jako ekran, który chroni zewnętrzne elektrony przyciągania jądra
Rysunek schematycznie pokazujący wewnętrzne elektrony działające jako ekran, który chroni zewnętrzne elektrony przyciągania jądra Na przykład obciążenie jądrowe atomu sodu wynosi +11 (jego liczba atomowa wynosi z = 11), ale jedyny elektron walencji, który posiada, faktycznie odczuwa siłę przyciągania obciążenia tylko +2,2.
Może ci służyć: benzoat sodu: struktura, właściwości, zastosowania i ryzykoInnymi słowy, ekranowanie pozostałych 10 elektronów wewnętrznych powoduje, że elektron sodu walencijak odczuwa siłę przyciągania jądrowego tylko piątego tego, co powinno być.
Oprócz efektu osłony, odpychanie między elektronami (które mają ten sam ładunek elektryczny) również przyczynia się do przeciwdziałania pojemności rdzenia w celu przyciągnięcia zewnętrznych elektronów. Oznacza to, że odpychanie to pomaga również zmniejszyć skuteczne obciążenie jądrowe.
Ważne cechy skutecznego obciążenia jądrowego
Należy zauważyć, że efekt osłony odpowiedzialny za zmniejszenie efektywnego obciążenia jądrowego wpływa tylko na elektrony, które znajdują się na tym samym poziomie energii lub w górnych warstwach, ale nie w najbardziej wewnętrznych elektronach. Ponadto efekt nie jest taki sam dla elektronów występujących w orbitalach atomowych S i P niż te znalezione w orbitalach D i F.
Z tego powodu każdy zestaw elektronów każdej warstwy lub poziomu energii odczuwa inne skuteczne obciążenie jądrowe. Ma to ważne implikacje dotyczące właściwości chemicznych różnych elementów.
Okresowy trend skutecznego obciążenia jądrowego
Przez okres
Elektrony znajdujące się na tym samym poziomie energii są mniejsze niż te występujące w niższych poziomach energii.
Z tego powodu efekt ekranowania nie wzrasta znacznie, gdy poruszamy się w danym okresie, ale rzeczywiste obciążenie nuklearne. Z tego powodu skuteczne obciążenie jądrowe wzrasta od lewej do prawej w stoliku okresowym.
W całej grupie
Z drugiej strony, przechodząc z jednego okresu do drugiego w tej samej grupie (to znaczy, gdy poruszamy się wzdłuż grupy), dodaje się całe warstwy bardzo ekranowych elektronów wewnętrznych. To sprawia, że efektywne obciążenie jądrowe zmniejsza się od góry do dołu lub, co jest takie samo, Wzrost od dołu do góry.
Może ci służyć: AyaroínaSkuteczny wzór obciążenia jądrowego
Skuteczne obciążenie jądrowe można obliczyć za pomocą bardzo prostego równania półtimka, które uwzględnia rzeczywistą wartość obciążenia jądrowego (podana przez liczbę atomową, z) i termin zwany stałym osłoną. Ten ostatni obejmuje skutki obecności innych elektronów w jednym.
Równanie jest podane przez:
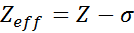
gdzie Z jest liczbą atomową, a σ (grecka litera sigma) reprezentuje stałą osłony, która zależy od konfiguracji elektronicznej.
Slater zasady
Stałą osłony można oszacować na podstawie systemu znanego jako zasady Slatera. Reguły te umożliwiają obliczenie stałej osłony elektronu poprzez dodanie wkładu innych elektronów do wspomnianej stałej osłony. Zasady te można podsumować w następujący sposób:
- Każdy elektron, który jest na tym samym poziomie energii (poziom n0) Zapewnia ilość 0,35 do stałej osłony, chyba że oba są na poziomie 1, w takim przypadku zapewnia 0,30.
- Każdy elektron, który jest na poziomie bezpośrednio poprzedni (na poziomie N0-1) W orbicie S lub P przynosi 0,85; Z drugiej strony, jeśli jest ono na orbicie d lub f, wnosi 1.
- Wszystkie inne elektrony, które są na niższych poziomach energii (n0-2, n0-3 itd.), przyczynij się do stałej osłony.
Przykład efektywnego obliczania obciążenia jądrowego
Elektron walencji atomu sodu
Konfiguracja elektroniczna atomu sodu wynosi 1s22s22 p63s1. To znaczy, że jeśli chcemy obliczyć efektywne obciążenie jądrowe, które odczuwa elektron Valencia (elektron 3s1), musimy dodać wkład pozostałych 10 elektronów zgodnie z zasadami Slatera.
Może ci służyć: tlenek żelaza (ii): struktura, nomenklatura, właściwości, zastosowaniaJak obliczamy stałą tarczy elektronów 3S1 (N0= 3) i jest to samo w warstwie Walencji, nie ma innych elektronów na tym samym poziomie energii.
Natychmiast poprzedni poziom to n0-1 = 2, gdzie jest 8 elektronów w orbitalach S lub P, które przyczyniają się do 0,85 każdego, i nie ma elektronów w orbitalach d lub f.
Wreszcie, jedynym poziomem niższym niż 2 to n = 1, w którym są tylko 2 elektrony. Wszystko to zostało podsumowane w poniższej tabeli:
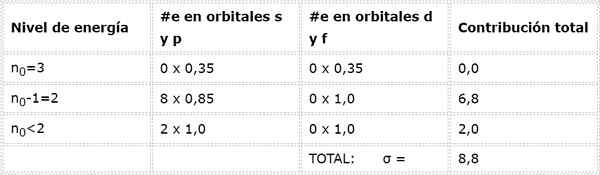
Jak widać, wewnętrzne elektrony sodu zapewniają stałą tarczy 8,8, więc efektywne obciążenie jądrowe, które elektron odczuwa 3s1 Jest:
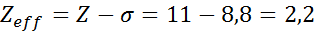
Elektrony arsenu Valencia
Arsenowa konfiguracja elektroniczna wynosi 1s22s22 p63s23p63d104s24p3. Warstwa Walencji to warstwa 4 (n0= 4) ma 5 elektronów: (4s24p3). W tym przypadku każdy z tych 5 elektronów odczuwa wpływ pozostałych 4, które znajdują się w tej samej warstwie, a pozostałe 28 elektronów wewnętrznych, jak pokazano w tabeli:
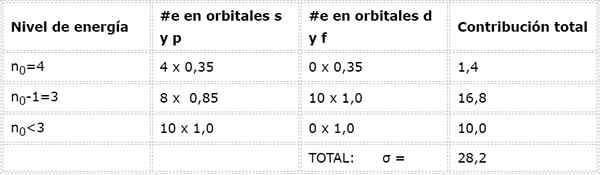
Dlatego efektywne obciążenie jądrowe, które odczuwają elektrony w Walencji Arseny, wynosi: