Węgiel

- 4273
- 882
- Paweł Malinowski
Co to jest węgiel?
On węgiel Jest to nie -metalowy element chemiczny, którego symbol chemiczny to C. Jego nazwa wynika z węgla, warzyw lub minerału, gdzie jego atomy definiują różne struktury. Tworzy szeroki zakres związków organicznych i nieorganicznych, a także przedstawia się w znacznej liczbie alotropów.
Węgiel występuje we wszystkich żywych istotach; Wszystkie jego biomolekuły zawdzięczają swoje istnienie stabilności i sile wiązań C-C oraz ich wysokiej skłonności do konatenowania. Jest to element życia, a wraz z ich atomami zbudowane są ich ciała.
Związki organiczne, z którymi budowane są biomateriały, składają się z szkieletów gazowanych i heteroatomy. Można je na pierwszy rzut oka widać w drewnie drzew; A także, gdy błyskawica na nich i Rostiza. Pozostała obojętna czarna substancja stała ma również węgiel; Ale jest to węgiel warzywny.
Właściwości węglowe
Właściwości fizyczne lub chemiczne występujące w ciałach stałych, minerałach lub materiałach węglowych podlegają wielu zmiennym. Wśród nich są: skład lub stopień zanieczyszczeń, hybrydy atomów węgla, różnorodność struktur oraz morfologia lub wielkość porów.
Kiedy opisują właściwości węgla, większość tekstów lub źródeł bibliograficznych opiera się na graficie i diamencie.
Ponieważ? Ponieważ są najbardziej znanymi szczelnymi odcinkami tego elementu i reprezentują stałe lub materiały o wysokiej czystości; Oznacza to, że są one praktycznie nie wytwarzane niczym więcej niż atomy węgla (chociaż z różnymi strukturami, jak zostanie wyjaśnione w poniższej sekcji).
Właściwości warzyw i węgla mineralnego różnią się odpowiednio pod względem pochodzenia lub kompozycji. Na przykład węgla brunatne (słaby węgiel) jako paliwo gatea w porównaniu z antracytem (bogatym w węgiel). I co powiedzieć o innych alotropach: nanorurki, fullerenos, grafen, grafos itp.
Jednak chemicznie mają wspólny punkt: utleniają się z nadmiarem tlenu w CO2:
C + ALBO2 => Co2
Teraz prędkość lub temperatura, której potrzebują do utleniania, są własnością dla każdego z tych alotropów.
Graphit vs Diamond
Tutaj zostanie również krótki komentarz dotyczący różnych właściwości dla tych dwóch alotropów:
 Tabela, w której porównywane są pewne właściwości dwóch krystalicznych alotropów węgla. Źródło: Gabriel Bolívar.
Tabela, w której porównywane są pewne właściwości dwóch krystalicznych alotropów węgla. Źródło: Gabriel Bolívar. Struktura elektroniczna i konfiguracja
Hybrydyzacja
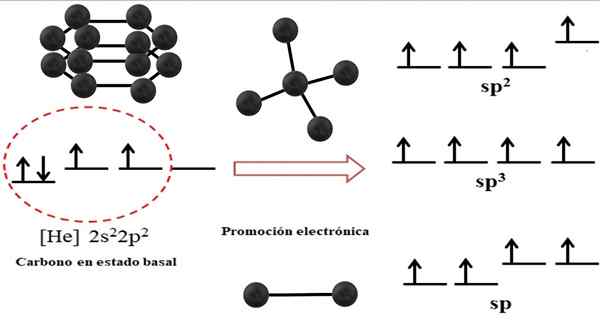 Zależność między orbitalem hybrydowym a możliwymi strukturami dla węgla. Źródło: Gabriel Bolívar.
Zależność między orbitalem hybrydowym a możliwymi strukturami dla węgla. Źródło: Gabriel Bolívar. Konfiguracja elektroniczna dla atomu węglowego wynosi 1s22s22 p2, napisane również jako [on] 2s22 p2 (obraz górny). Ta reprezentacja odpowiada jej podstawowym statusowi: atom węgla izolowany i zawieszony w takiej próżni, która nie może oddziaływać z innymi.
Może ci służyć: struktura krystalicznaDoceniamy, że jeden z jego orbitali 2P brakuje elektronów, który akceptuje elektron z mniejszej orbity energetycznej przez promocję elektroniczną; I dlatego atom nabywa zdolność do tworzenia do czterech kowalencyjnych wiązań poprzez cztery hybrydowe orbitale SP3.
Zauważ, że cztery orbitale sp SP3 Są one zdegenerowane energią (wyrównane na tym samym poziomie). Orbitale P Czyste są bardziej energetyczne, dlatego znajdują się powyżej innych hybrydowych orbitali (po prawej stronie obrazu).
Jeśli istnieją trzy hybrydowe orbitale, dzieje się tak P bez hybrydyzacji; Dlatego są to trzy orbitale SP2. A gdy istnieją dwa z tych hybrydowych orbitali, dwa orbitale P Są dostępne do tworzenia podwójnych lub potrójnych wiązań, będąc hybrydyzacją węgla f.
Takie aspekty elektroniczne są niezbędne do zrozumienia, dlaczego węgiel można znaleźć w nieskończonościach wolności.
Liczby utleniania
Przed kontynuowaniem struktur nie wspomina o tym, biorąc pod uwagę elektroniczną konfigurację Valencia 2S22 p2, Węgiel może mieć następujące liczby utleniania: +4, +2, 0, -2 i -4.
Ponieważ? Liczby te odpowiadają założeniu, że istnieje wiązanie jonowe, tak że tworzysz jony z odpowiednimi obciążeniami; to znaczy c4+, C2+, C0 (neutralny), c2- i C4-.
Aby węgiel miał dodatnią liczbę utleniania, musi stracić elektrony; Aby to zrobić, koniecznie musi być powiązane z bardzo elektroonywymi atomami (takimi jak tlen).
Tymczasem, aby węgiel miał negatywną liczbę utleniania, musi zyskać elektrony łączące się z metalem lub mniej atomami elektroungatywnymi niż on (taki jak wodór).
Pierwszy problem utleniania, +4, oznacza, że węgiel stracił wszystkie elektrony walencyjne; Orbitale 2s i 2p są puste. Jeśli orbital 2p straci dwa elektrony, węgiel będzie miał +2 liczbę utleniania; Jeśli wygrasz dwa elektrony, będziesz miał -2; A jeśli wygra dwa elektrony bardziej, ukończąc swój okT z Walencji, -4.
Przykłady
Na przykład dla CO2 Numer utleniania węgla wynosi +4 (ponieważ tlen jest bardziej elektroonywalny); podczas gdy Cho4, IS -4 (ponieważ wodór jest mniej elektroonywalny).
Może ci służyć: hydrazyna: struktura, właściwości, synteza, zastosowaniaDla Ch3Och, numer utleniania węgla wynosi -2 (+1 dla H i -2 dla O); Podczas gdy dla HCOOH wynosi +2 (sprawdź, czy suma 0).
Prawdopodobne są również inne stany utleniania, takie jak -3 i +3, szczególnie jeśli chodzi o cząsteczki organiczne; Na przykład w grupach metylowych -ch3.
Geometrie molekularne
Na obrazie wyższym pokazano nie tylko hybrydyzację orbitali dla atomu węgla, ale także powstałe geometrie molekularne, gdy kilka atomów (czarnych kulek) jest powiązanych z centralnym. Ten centralny atom do pozbycia się określonego środowiska geometrycznego w przestrzeni, musi posiadać odpowiednią hybrydyzację chemiczną.
Na przykład dla czworościanu centralny węgiel ma hybrydyzację SP3; Ponieważ takie jest najbardziej stabilne układ dla czterech hybrydowych sp3. W przypadku węgli SP2, Mogą tworzyć podwójne linki i usuwać trygonalne płaskie środowisko; I tak, te trójkąty definiują idealny sześciokąt. A do hybrydyzacji SP węgły przyjmują geometrię liniową.
Zatem geometrie obserwowane w strukturach wszystkich szczelnych jest po prostu rządzone w tetrahedrze (sp SP3), sześciokąt lub pentagony (sp SP2) i linie (sp).
Tetrahedra definiują strukturę 3D, podczas gdy heksagony, pentagony i linie, struktury 3D lub 2D; Te ostatnie stają się samolotami lub arkuszami podobnymi do ścian plastra miodu pszczół:
 Ściana z sześciokątnymi wzorami miodu pszczół w analogii do samolotów złożonych z węgli SP2. Źródło: Pixabay.
Ściana z sześciokątnymi wzorami miodu pszczół w analogii do samolotów złożonych z węgli SP2. Źródło: Pixabay. A jeśli złożymy tę sześciokątną ścianę (pięciokątną lub mieszaną), otrzymamy rurkę (nanorurki) lub kulkę (fullerene) lub inną figurę. Interakcje między tymi liczbami powodują różne morfologie.
Amorficzne lub krystaliczne stałe
Pozostawiając geometrię, hybrydyzacje lub morfologie możliwych struktur węglowych, ich ciała stałe mogą klasyfikować na całym świecie na dwa typy: amorficzne lub krystaliczne. A między tymi dwiema klasyfikacjami ich alotropy są rozmieszczone.
Amorficzny węgiel jest po prostu tym, który przedstawia dowolną mieszaninę tetrahedry, sześciokątów lub linii, niezdolną do ustalenia wzoru strukturalnego; Tak jest w przypadku węgla, warzyw lub aktywowanego węgla, koksu, sadzy itp.
Podczas gdy węgiel krystaliczny składa się z wzorów strukturalnych utworzonych przez dowolną z podniesioną geometrię; Na przykład Diamond (trzy -wymiarowa sieć tetrahedra) i grafit (ułożone arkusze sześciokątne).
Może ci służyć: azotan sodu (nano3): struktura, właściwości, zastosowania, ryzykoGdzie jest węgiel?
Oprócz bycia elementem chemicznym wspólnym we wszystkich formach życia, węgiel w naturze jest obecny w trzech postaciach krystalicznych: diament, grafit i przewodnik.
Istnieje również kilka amorficznych form minerałów węgla (antracyt, węgla brunaty, głupi, torf), formy cieczy (odmiany ropy naftowej) i sody (gaz ziemny).
Aplikacje
Ponownie, podobnie jak właściwości i struktura, zastosowania lub zastosowania są zgodne z alotrogos lub mineralogicznymi formami węgla. Istnieją jednak pewne ogólności, o których można wspomnieć, oprócz niektórych bardzo znanych punktów. Takie są:
-Węgiel był używany od dawna jako środek redukujący minerał w uzyskiwaniu czystych metali; Na przykład żelazo, krzem i fosfor, między innymi.
-Jest to kamień węgielny życia, a chemia organiczna i biochemia są badaniami tego refleksji.
-Było to również paliwo kopalne, które pozwoliło pierwszemu maszynom udać się na biegi. W ten sam sposób uzyskano od niego gaz węglowy dla starych systemów oświetleniowych. Węgiel był synonimem światła, ciepła i energii.
-Zmieszane jako dodatek z żelazem w różnych proporcjach umożliwia wynalezienie i poprawa stali.
-Jego czarny kolor miał miejsce w sztuce, zwłaszcza grafit i wszystkie pisma wykonane z ich pociągnięć.
Ryzyko i środki ostrożności
Węgiel i jego stałe nie reprezentują żadnego zagrożenia dla zdrowia. Który martwił się o torbę węglową? Sprzedają je na działki w korytarzach niektórych rynków, a dopóki nie ma bliskiego ognia, ich czarne bloki nie spali się.
Z drugiej strony koks może reprezentować ryzyko, jeśli jego zawartość siarki jest wysoka. Kiedy spalanie uwolni gazy siarki, które oprócz toksycznych, przyczyniają się do kwaśnego deszczu. I chociaż CO2 W małych ilościach nie może nas dusić, ma ogromny wpływ na środowisko jako gaz cieplarniany.
Z tej perspektywy węgiel jest niebezpieczeństwem „długoterminowym”, ponieważ jego spalanie zmienia klimat naszej planety.
Oraz w bardziej fizycznym sensie stałe lub materiały węglowe, jeśli są spryskane, są łatwo transportowane przez prądy powietrzne; I w konsekwencji są one wprowadzane bezpośrednio do płuc, które mogą ich nieodwracalnie uszkodzić.
Reszty bardzo często spożywanie „węgla”, gdy gotuje trochę jedzenia.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.

