Struktura węglanu wapnia, właściwości, formacja, wykorzystanie

- 4081
- 400
- Bertrand Zawadzki
On węglan wapnia Jest to związek nieorganiczny, którego wzorem chemicznym jest CACO3. Występuje głównie w minerałach, takich jak kalcyt i aragonit. Podobnie wapień komponuje się, skała osadowa, w której obecny jest minerał kalcyta.
Ten ważny węglan metalu jest uzyskiwany przemysłowo przez ekstrakcję i szlifowanie minerałów, które go zawierają; W tym celu używa się głównie marmuru. Inny proces polega na zastosowaniu tlenku wapnia, który staje się wodorotlenkiem wapnia, wytrącając węglan wapnia przez dodanie dwutlenku węgla. W ten sposób kryształy są uzyskiwane z szerokiego zakresu rozmiarów.
 Skorupa ślimaka składa się głównie z węglanu wapnia. Źródło: Pixabay.
Skorupa ślimaka składa się głównie z węglanu wapnia. Źródło: Pixabay. Mogą być również używane do produkcji przemysłowej CACO3, Na małą skalę, skorupy małży, skorupy jaj i skorupy ostrygowe, w których są obecne.
Węglan wapnia obecny w wapieniu rozpuszczany jest przez dwutlenek węgla w wodzie, wytwarzając wodorowęglan wapnia. To działanie może powodować jaskinie i jest przyczyną zasadowej wody; wydarzenie o dużej wagi w utrzymaniu życia w IT.
Został użyty w budowie i opracowaniu rzeźb; Przykładami tego są partner Ateny, katedra Krakowa i rzeźba Abrahama Lincolna w Waszyngtonie. Jednak jego podatność na kwasowy deszcz zmniejszyła jego zastosowanie w budownictwie.
Węglan wapnia miał wiele zastosowań w branży jako materiał napełniający z tworzywa sztucznego i papieru. W medycynie zastosowano go do kontrolowania kwasowości żołądka; jako suplement wapnia w diecie; kontrolować fosfatię u pacjentów z przewlekłą niewydolnością nerek itp.
[TOC]
Struktura
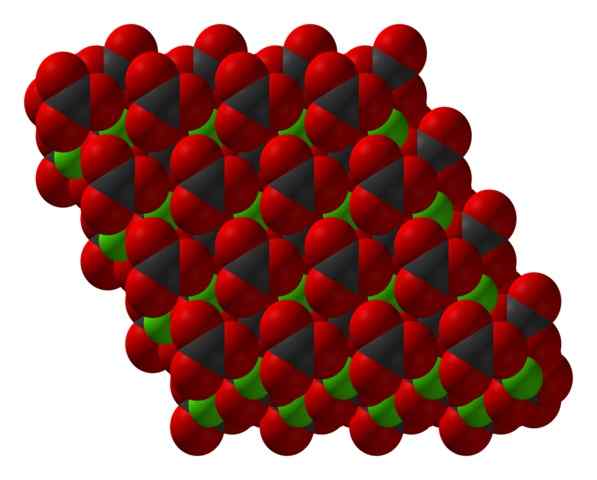 Struktura krystaliczna Chanco3 reprezentowana za pomocą modelu wypełnienia przestrzeni. Źródło: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Struktura krystaliczna Chanco3 reprezentowana za pomocą modelu wypełnienia przestrzeni. Źródło: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Wzór węglanowy wapnia, caco3, wskazuje, że proporcja między jonami CA2+ i co32- To jest 1: 1; to znaczy dla każdego CA2+ Jest Co32- odpowiednika interakcji z nim elektrostátycznie. Zatem wiązanie jonowe ma te jony, tworząc wzorce strukturalne, które definiują kryształ.
Na górnym obrazie pokazano strukturę kako3. Zielone kule odpowiadają kationom CA2+, oraz czerwone i czarne kule do anionów CO32-. Należy zauważyć, że struktura wydaje się być utworzona przez wiele warstw: jedną z wapnia i drugiego węglanu; co oznacza, że krystalizuje się w zwartej sześciokątnej strukturze.
Może ci służyć: chlorek amonu (NH4Cl)Ta faza sześciokątna (β-caco3) Odpowiada polimorfowi. Istnieją dwa inne: ortorrombiczne (λ-caco3) i nawet najsilniejszy sześciokąta (μ-caco3). Niższy obraz pomaga lepiej wizualizować szczęśliwy sześciokąt:
 Sześciokątna struktura kalcytu. MaterialScientist z angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Sześciokątna struktura kalcytu. MaterialScientist z angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Jednak w zależności od temperatury (i dla tej soli ciśnienie) jony w ich wibracjach są dostosowane do innych struktur; Są to wspomniane polimorfy (β, λ i μ).
Ponieważ brzmią, nie są dobrze znane, chyba że są wymienione z ich nazwami mineralogicznymi w następnym rozdziale.
Twardość białka
Kryształy Caco3 Nie są sami: mogą gościć zanieczyszczenia, takie jak inne metalowe kationy, które farbują je w kolorach; O białka, zawierające matrycę organiczną, która w jakiś sposób przyczynia się do jej naturalnej twardości.
Białka zmniejszają napięcie doświadczane przez kryształy od siebie przed ciśnieniem lub uderzeniem. Jak? Podczas przeplatania się między kryształami, działając tak, jakby był to „podkładka” (podobnie jak w cegierze-cementu).
Dlatego ten związek lub minerał jest biokompatybilny i nie jest zaskoczony, że jest częścią paznokci, skorup morskich, skorupek lub kości jeży. To było źródłem inspiracji dla tych, którzy są poświęcone opracowywaniu nowych materiałów.
Nieruchomości
Inne nazwy
-Aragonit
-Calcito
-Volterite
-Mleko wapnia
-Biała tablica
-Marmur
Masa cząsteczkowa
100 086 g/mol.
Opis fizyczny
Biała toaleta.
Smak
Podobne do kredy, bez smaku.
Punkty fuzji i wrzenia
Załamuje się, ponieważ uwalnia CO2 Przed stopieniem lub gotowaniem.
Rozpuszczalność
Praktycznie nierozpuszczalny w wodzie i alkoholu. Rozpuszcza się z musowaniem w rozcieńczonych kwasach ocowych i solnych. Jednak wodorotlenki zmniejszają swoją rozpuszczalność. Tymczasem sole amonowe i dwutlenek węgla zwiększają rozpuszczalność węglanu wapnia w wodzie.
Gęstość
2,7 do 2,95 g/cm3.
Rozkład
Około 825 ° C jest podzielone na tlenek wapnia (wapno) i dwutlenek węgla (CO2).
Ph
8 do 9
Współczynnik załamania światła
-1 7216 do 300 nm i od 16584 do 589 nm (Callita).
-15145 do 300 nm i od 14864 do 589 nm (aragonit).
Niezgodności
Z kwasami, soleami glinowymi i amonowymi.
Entalpia fusion
36 kJ/mol przy 800 ° C (kalcyt).
Może ci służyć: molowość: koncentracja, jednostki, obliczenia, ćwiczeniaStała produktu rozpuszczalności
3,36 · 10-9 w 25 ° C.
Twardość
-3.0 (kalcyt)
-3,5 - 4.0 (aragonit) w skali MOHS.
Przejścia fazowe
Aragonit jest metastabilny i nieodwracalnie zmienia się na kalcyt, gdy ogrzewa go w suchym powietrzu do 400 ° C.
Reaktywność
Węglan wapnia reaguje z kwasami, uwalniając dwutlenek węgla, jonowy wapń i woda.
Węglan wapnia łączy się z nasyconą wodą z dwutlenkiem węgla, równoważnym z kwasem węglowym (H (H H2WSPÓŁ3), Aby utworzyć wodorowęglan wapnia.
Szkolenie
Kreda, marmur i wapień, pierwsze dwa minerały i materiał skalisty trzeci, zawierają węglan wapnia i mają pochodzenie osadowe, uważa się, że są one utworzone przez sedymentację ślimaków przez miliony lat.
PH może być najważniejszym czynnikiem w tworzeniu polimorfów w temperaturze 24 ° C. Vaterita jest głównym produktem w zakresie pH między 8,5 a 10; Aragonit ma pH 11; i kalcyt do pH> 12.
Wiadomo również, że wiele glonów świeżej wody buduje kryształy kalcytu, gdy rosną w środowisku nasyconym wapniem. Ponadto mikroalgi są w stanie powodować wytrącanie węglanu wapnia.
Formy węglanu wapnia
Na poniższych obrazach trzy główne kształty lub polimorfy zostaną pokazane dla węglanu wapnia:
 Callita Crystal. Źródło: Parent Géry [domena publiczna]
Callita Crystal. Źródło: Parent Géry [domena publiczna] Kryształ aragonitu. Źródło: Battistini Riccardo [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Kryształ aragonitu. Źródło: Battistini Riccardo [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Kryształy vaterita. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Kryształy vaterita. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Z góry na dole znajdują się polimorfy kalcytu, aragonitu i vaterita. Zwróć uwagę na różnicę między morfologią ich kryształów (kolor jest typowy dla jej pochodzenia i charakterystyk jego środowisk).
Vaterita jest bardziej nieprzezroczysta niż kalcyt, a ten ostatni staje się jeszcze kompletny. Tymczasem kryształy aragonitowe przypominają małe wydłużone monolity.
Jeżeli próbki tych trzech polimorfów są obserwowane pod mikroskopem elektronicznym, ich kryształy (tonów szarej, ponieważ technika nie pozwala na rozdzielczość kolorów), te same morfologie można znaleźć jak w skalach makroskopowych; to znaczy na pierwszy rzut oka.
Spośród tych trzech polimorfów kalcyt jest najliczniejszy i stabilny, a następnie aragonit, a wreszcie Vaterita, najrzadszy z form kako3
Może ci służyć: kalorymetria: jakie badania i zastosowaniaAplikacje
Przemysłowcy
Węglan wapnia zwiększa odporność na skręcenie i przyczepność syntetycznej i naturalnej gumy, utrzymując jego elastyczność. Jest stosowany w branży budowlanej jako składnik cementu i jako surowiec do wapna. Jego zastosowanie zostało zmniejszone, ponieważ jest uszkodzone przez kwasowy deszcz.
Węglan wapnia jest stosowany w oczyszczaniu żelaza. W postaci wapna eliminuje dwutlenek siarki obecny w metalu. Stosuje się oczyszczanie cukru buraków. Był używany jako kreda do łupków, ale został zastąpiony tynkiem dla tej aplikacji.
Węglan wapnia jest mieszany z kitem stosowanym w umieszczeniu szkła. Ziemia jest używana jako materiał napełniający w mikroporowatej folii stosowanej w pieluchach. Jest również używany jako materiał napełniający w tworzyw sztucznych, takich jak PVC. Ponadto wytrzymałość plastiku wzrasta.
Węglan wapnia służy do zwiększenia pojemności pokrycia obrazów. Jest używany jako materiał do napełniania papieru, ponieważ jest tańszy niż włókno drewniane, jest w stanie reprezentować więcej niż 10% papieru.
Lekarze
Jest stosowany jako zobojętnienie do zwalczania hiperacydności żołądka i złagodzenia niestrawności. Jest stosowany jako suplement wapnia w diecie oraz w leczeniu i zapobieganiu osteoporozy. Jest stosowany w leczeniu hiperfosfatii u pacjentów z przewlekłą niewydolnością nerek.
Zastosowano go w celu zmniejszenia niepożądanych działań inhibitorów proteazy stosowanych w leczeniu HIV, obserwując u pacjentów zmniejszenie biegunki.
Powoduje spadek ciśnienia krwi u kobiet w ciąży z nadciśnieniem i stanem przedrzucawkowym, ponieważ oba mogą być związane ze wzrostem zapotrzebowania wapnia z powodu obecności płodu.
Inni
Węglan wapnia jest stosowany w rolnictwie jako nawóz i w celu zwalczania kwasowości gleby. Jest używany jako konserwujący, ustalający kolor i potwierdzający jedzenie.
Ponadto jest składnikiem pasty do zębów i służy jako ścierny w pyle w czyszczeniu i myciu.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Węglone wapń. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2019). Węglone wapń. Baza danych Pubchem., CID = 10112. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Kai-Yin Chong, Chin-Hua Chia i Sarani Zakaria. (2014). Polimorfy węglan wapnia podczas reakcji temperatury. Postępowanie konferencyjne AIP 1614, 52; doi.Org/10.1063/1.4895169
- Greg Watry. (1 listopada 2016). Odkrywanie howie kryształów węglanowych zyskuje siłę. Advantage Business Marketing. Odzyskany z: rdmag.com
- Elementy amerykańskie. (2019). Węglone wapń. Pobrano z: Americlements.com
- Elsevier. (2019). Węglone wapń. Scientedirect. Pobrano z: Scientedirect.com
- Książka chemiczna. (2017). Węglone wapń. Odzyskany z: chemicalbook.com

