Calcogeny lub amphumos
- 4328
- 1103
- Marianna Czarnecki
 Elementy kalcynowe. Źródło: Gabriel Bolívar
Elementy kalcynowe. Źródło: Gabriel Bolívar Co to są Calcogeny lub amphumos?
Calcogeny albo Anfigenos Są to pierwiastki chemiczne należące do grupy lub rodziny tlenu w stole okresowym. Znajdują się w grupie o lub 16, znajdują się po prawej stronie lub blok p.
Głowa grupy, jak sama nazwa wskazuje, jest zajęta przez element tlenu, który fizycznie i chemicznie różnią się od elementów tej samej grupy. Słowo „calcogen” pochodzi od greckiego słowa Chalcos, Co oznacza miedź.
Wiele chemikaliów nazwał te elementy trenerami popiołów, kredów, brązów i łańcuchów. Jednak najbardziej udana interpretacja odpowiada interpretacji „formatorów minerałów”.
Zatem Calcogeny charakteryzują się obecnością w niezliczonych minerałach, takich jak krzemiany, fosforany, tlenki, sulfidy, seleniuros itp.
Z drugiej strony słowo „ampigen” oznacza „zdolne do tworzenia kwasu lub podstawowych związków”. Prostym przykładem tego jest fakt, że istnieją kwas i podstawowe tlenki.
Tlenu można nie tylko znaleźć w powietrzu, które jest oddychane, ale jest również częścią 49% skorupy Ziemi. Dlatego nie wystarczy spojrzeć na chmury, aby mieć go na głowę, i kontemplować maksymalną fizyczną manifestację Calcogenów, konieczne jest odwiedzenie góry lub rudy.
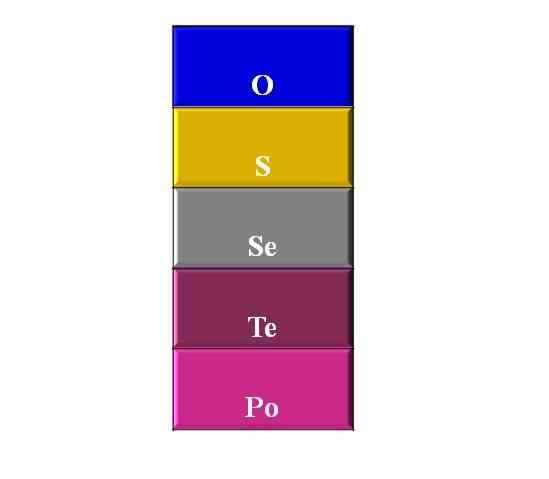
Górny obraz pokazuje kolumnę lub grupę ze wszystkimi jej pierwiastkami, na czele tlenem. Nazywanie ich w porządku potomnym to: tlen, siarka, selen, telurio i polon.
Chociaż nie jest to pokazane, syntetyczny, radioaktywny element znajduje się pod polonem, a drugi najcięższy po Oganeseon: Light (LV).
Tlen
Tlen występuje w naturze głównie jako dwa alotropy: o2, tlen cząsteczkowy lub diatomowy i o3, ozon. Jest to gaz w warunkach naziemnych i jest uzyskiwany z upłynnienia powietrza. W stanie płynnym przedstawia blade niebieskawe tony, a w postaci ozonu może tworzyć czerwonawe brązowe sole zwane Orzónidos.
Może ci służyć: wodorotlenek amonuSiarka
Naturalnie przedstawia dwadzieścia różnych alotropów, będąc najczęstszym ze wszystkich, S8, „Korona siarki”. Siarka jest zdolna do tworzenia się ze sobą cyklicznymi cząsteczkami lub łańcuchami spiralnymi z kowalencyjnymi wiązaniami S-S ... jest to znane jako hatenation.
W normalnych warunkach jest to żółta substancja stała, której czerwonawe i zielonkawe zabarwienie zależą od liczby atomów siarki, które tworzą cząsteczkę. Tylko w fazie gazowej znajduje się ją jako cząsteczka okrzemkowa s = s, s,2, Podobne do tlenu molekularnego.
Selen i telurio
Selen tworzy krótkie łańcuchy niż siarka, ale z wystarczającą różnorodnością strukturalną, aby znaleźć czerwone, krystaliczne i czarne amorficzne alotropy.
Niektórzy uważają to za metaloid, a inne za element niemetaliczny. Zaskakujące jest to niezbędne dla żywych organizmów, ale w bardzo niskich stężeniach.
Z drugiej strony telurio krystalizuje się jako szarawo stałe i ma cechy i właściwości metaloidu. Jest to bardzo rzadki pierwiastek w korze Ziemi, znajdując się w małych stężeniach w rzadkich minerałach.
Polon
Spośród wszystkich kalpogenów jest to jedyny element metaliczny, ale, podobnie jak jego 29 izotopów (i inne), jest niestabilny, wysoce toksyczny i radioaktywny. Występuje jako ślad w niektórych minerałach uranu i dymu tytoniowym.
Nieruchomości
Konfiguracja elektroniczna i stanów Walencji
Wszystkie kalkuny mają tę samą konfigurację elektroniczną: NS2NP4. Mają, jest sześć elektronów Walencji. Będąc w bloku P, po prawej stronie stolika okresowego, mają tendencję do zdobywania elektronów niż ich utraty, dlatego dwa elektrony zarabiają na ukończenie oktetów walencji i nabycia w konsekwencji Valencia -2 -2.
Może ci służyć: chlorek litowy (LICL): właściwości, ryzyko i zastosowaniaMogą również stracić sześć elektronów walencji, będąc ze stanem +6.
Możliwe stany Walencji dla kalkulów różnią się od -2 do +6, a te dwa są najczęstsze. W miarę, jak grupa schodzi (od tlenu do polonu), tendencja elementów przyjęcia dodatnich stanów walencyjnych wzrasta, co jest równe wzrostowi charakteru metalicznego.
Na przykład tlen nabywa prawie we wszystkich swoich związkach stan Walencja -2, z wyjątkiem sytuacji, gdy tworzy powiązania z fluorkiem, zmuszając go do utraty elektronów ze względu na większą elektrooniczność, przyjmując stan walencji +2 (z OF z2). Nadtlenki są również przykładem związków, w których tlen ma walencję z -1, a nie -2.
Charakter metaliczny i niemetaliczny
Gdy grupa opada, radiotelefony atomowe wzrasta, a wraz z nimi właściwości chemiczne pierwiastków są modyfikowane. Na przykład tlen jest gazem, a termodynamicznie jest bardziej stabilny jak cząsteczka dwuatomiczna O = O, niż jako „łańcuch utleniany” O-O-O-O ..
Jest to grupa większego niemetalicznego charakteru grupy, a zatem tworzą kowalencyjne związki ze wszystkimi elementami bloku P i niektórymi metaliami przejściowymi.
Znak niemetaliczny maleje wraz ze wzrostem charakteru metalicznego. Znajduje to odzwierciedlenie we właściwościach fizycznych, takich jak punkty wrzenia i fuzji, które rosną z siarki do polonu.
Inną cechą wzrostu charakteru metalicznego jest wzrost konfiguracji krystalicznych związków utworzonych przez telurio i polon.
Związki
Niektóre związki utworzone przez Calcogeny są ogólnie wspomniane poniżej.
Może ci służyć: Isopentano: Struktura, właściwości, użycia, uzyskanieHydrory
-H₂o
-H2S
Według nomenklatury IUPAC nazywa się ją siarkowodorem, a nie wodorkiem siarki, ponieważ H nie ma walencji -1.
-H2ON
Podobnie jest nazwany jako seleniuro wodoru, a także reszta Hydros.
-H2Herbata
-H2PO
Wodnik tlenu to woda. Pozostałe są śmierdzące i trujące, będąc istotą2Jest najbardziej znany ze wszystkich, nawet w kulturze popularnej.
Sulfidy
Wszyscy mają wspólnego anionu2- (Najprostszy). Wśród nich są:
-Mgs
-Fes
-CUFES2
-Na2S
-BAS
W ten sam sposób są Selenuros, wiem2-, Telenuros, Te2-, i Polonuros, PO2-.
Halogenomory
Kalkogeny mogą tworzyć związki z halogenami (F, Cl, Br, I). Niektórzy z nich są:
-Tei2
-S2F2
-Z2
-Scl2
-SF6
-Sebr4
Tlenki
Wreszcie są tlenki. W nich tlen ma wartościowość -2 i może być jonowy lub kowalencyjny (lub mieć cechy obu). Mają na przykład następujące tlenki:
-południowy zachód2
-Teo2
-Ag2ALBO
-Wiara2ALBO3
-H₂O (tlenek wodoru)
-Seo3
Istnieją inne setki tysięcy związków, które obejmują interesujące stałe struktury. Ponadto mogą one przedstawić policycję lub policycje, szczególnie w przypadkach siarki i selenu, których łańcuchy mogą zdobywać dodatnie lub ujemne obciążenia i oddziaływać z innymi gatunkami chemicznymi.
Bibliografia
- Chalcogeny. Advameg. Odzyskane z ChemistryExplaed.com.

