Buteno

- 4298
- 790
- Eugenia Czapla
 Struktura chemiczna buteenu
Struktura chemiczna buteenu Co to jest Buteno?
On Buteno Jest to nazwa, która odbiera serię czterech izomerów o wzorze chemicznym C4H8. Są alkenami lub olefinami, to znaczy mają podwójne wiązanie c = c w swojej strukturze. Ponadto są to węglowodory, które można znaleźć w złożach oleju lub powstały w wyniku pęknięcia termicznego i uzyskaniu produktów o niższej masie cząsteczkowej.
Cztery izomery reagują z ciepłem uwalniającym tlen i żółtym płomieniem. Mogą również reagować z szerokim widmem małych cząsteczek, które są dodawane do podwójnego wiązania.
Ale jakie są izomery Buteno? Na górnym obrazie struktura z białymi kulami (hydrogeny) i czarne (węglowodany) jest reprezentowana dla 1-butenu. 1-buten jest najprostszym izomerem węglowodorów C4H8.
Zauważ, że istnieje osiem białych kul i cztery czarne kulki, co zgadza się z formułą chemiczną.
Pozostałe trzy izomery to cis i trans 2-buten i izo-butene. Wszystkie wykazują bardzo podobne właściwości chemiczne, chociaż ich struktury powodują różnice właściwości fizycznych (punkty fuzji i wrzenia, gęstości itp.).
Ponadto ich widma mają podobne wzorce pasm absorpcyjnych.
Zostanie potocznie 1-buten nazywany jest Buteno, chociaż 1-buten odnosi się tylko do jednego izomeru, a nie ogólnej nazwy. Te cztery związki organiczne to gazy, ale można je upłynić do wysokich ciśnień lub kondensów.
Są źródłem ciepła i energii, odczynników do syntezy innych związków organicznych, a przede wszystkim niezbędne do produkcji sztucznej gumy po syntezy butadienu.
Właściwości fizyczne i chemiczne Buteno
Waga molekularna
56.106 g/mol. Ta waga jest taka sama dla wszystkich izomerów wzoru C4H8.
Aspekty fizyczne
Jest to bezbarwny i łatwopalny gaz (jak inne izomery) i ma stosunkowo aromatyczny zapach.
Punkt wrzenia
Punkty wrzenia izomerów Buteno są następujące:
1 -Buten: -6º C
CIS-2-buten: 3.7. c
Trans-2-buten: 0.96º c
2 -metylopropen: -6.9º c
Temperatura topnienia
1 -Buten: -185.3. c
Cis-2-buten: -138.9º c
Trans-2-buten: -105.5. c
2 -metylopropeno: -140.4 c
Rozpuszczalność
Buteno jest bardzo nierozpuszczalny w wodzie ze względu. Jednak idealnie rozpuszcza się w niektórych alkoholi, takich jak benzen, toluen i etery.
Gęstość
0.577 do 25º C. Dlatego jest mniej gęsty niż woda i w pojemniku znajdowałby się powyżej tego samego.
Reaktywność
Jak każda alkena, jego podwójne wiązanie jest podatne na dodanie cząsteczek lub utlenianie. To sprawia, że Buteno i jego izomery reaktywne. Z drugiej strony są to łatwopalne substancje, więc przed nadmiarem temperatury reagują z tlenem powietrza.
Może ci służyć: Butanal: Struktura, właściwości, zastosowania i ryzykoStruktura chemiczna buteenu
Na górnym obrazie reprezentowana jest struktura 1-butenu. Po lewej stronie możesz zobaczyć lokalizację podwójnego wiązania między pierwszym a drugim węglem.
Cząsteczka ma strukturę liniową, chociaż region wokół łącza C = C jest płaski z powodu hybrydyzacji SP2 tych węgli.
Gdyby cząsteczka 1-butenowa została obrócona pod kątem 180º, ta sama cząsteczka nie miałaby widocznych zmian, dlatego brakuje jej aktywności optycznej.
Jak oddziaływałyby twoje cząsteczki? Linki C-H, C i C-C są natury apolarne, więc żaden z nich nie współpracuje w tworzeniu momentu dipolowego.
W konsekwencji cząsteczki cho2= Chch2Ch3 Muszą wchodzić w interakcje za pośrednictwem londyńskich sił dyspersji.
Prawy koniec buteenu tworzy natychmiastowy dipol, który w niewielkiej odległości polaryzuje sąsiednie atomy sąsiedniej cząsteczki. Z drugiej strony, lewy koniec linku C = C, oddziałuje zachodzące na siebie chmury π na drugiej (takie jak dwa wafle lub arkusze).
Ponieważ istnieją cztery atomy węgla składające się z szkieletu molekularnego, jego interakcje nie wystarczą, aby faza ciekła miała temperaturę wrzenia -6º C.
Izomery konstytucyjne i geometryczne
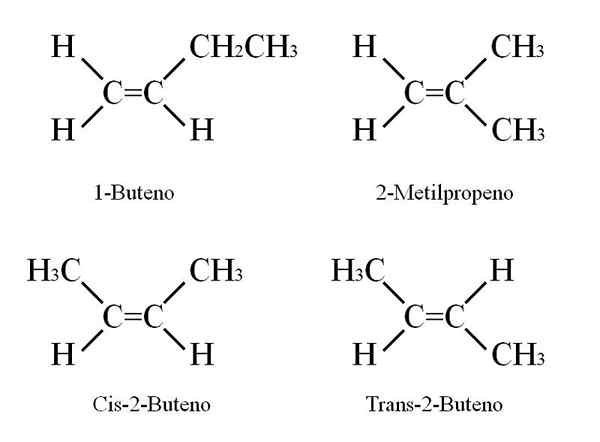 Struktury butynowe. Źródło: Gabriel Bolívar
Struktury butynowe. Źródło: Gabriel Bolívar 1-buten ma wzór molekularny C4H8; Jednak inne związki mogą mieć w swojej strukturze taki sam odsetek atomów C i H.
Jak to jest możliwe? Jeśli struktura 1-butenu jest obserwowana ostrożnie, można wymienić podstawniki węgla c = c. Ta wymiana wytwarza inne związki z tego samego szkieletu.
Ponadto pozycja podwójnego wiązania między C-1 i C-2 może przesunąć się w kierunku C-2 i C-3: CH3CH = CHCH3, 2-buten.
W 2-butenu atomy H można umieścić po tej samej stronie podwójnego wiązania, co odpowiada stereoizomerowi CIS; lub w przeciwnej orientacji przestrzennej, w transisomorze trans. Oba stanowią tak zwane również izomery geometryczne. To samo dotyczy grup -ch3.
Podobnie zauważ, że jeśli pozostanie w cząsteczce Cho3CH = CHCH3 Atomy H z jednej strony i grupy CH3 W innym uzyskano by izomer konstytucyjny: CH2= C (CH3)2, 2-metylopropen (znany również jako izo-buten).
Może ci podać: azotan potasu (KNO3)Te cztery związki mają ten sam wzór C4H8 Ale różne struktury. 1-buten i 2-metylopropen są izomerami konstytucyjnymi; oraz cis i trans-2-buten, geometryczne izomery między nimi dwa (i konstytucyjne w odniesieniu do reszty).
Stabilność
Ciepło spalania
Z górnego obrazu, który z czterech izomerów reprezentuje najbardziej stabilną strukturę? Odpowiedź można znaleźć na przykład w ciepłach spalania każdego z nich.
Podczas reakcji z tlenem izomer o wzorze C4H8 jest przekształcony w CO2 Zwolnienie wody i ciepła:
C4H8(g) + 6o2(g) => 4co2(g) + 4h2O (g)
Spalanie jest egzotermiczne, więc im więcej ciepła jest uwalniane, tym bardziej niestabilne jest węglowodory. Dlatego z czterech izomerów, które uwalnia mniej ciepła do spalania w powietrzu, będzie najbardziej stabilny.
Korzystanie spalania dla czterech izomerów to:
-1-buten: 2717 kJ/mol
-CIS-2-buten: 2710 kJ/mol
-Trans-2-buten: 2707 kJ/mol
-2-metylopropeno: 2700 kJ/mol
Zauważ, że 2-metylopropen jest izomerem, który daje mniej ciepła. Podczas gdy 1-buten jest tym, który uwalnia najwięcej ciepła, co przekłada się na większą niestabilność.
Efekt steryczny i elektroniczny
Ta różnica stabilności między izomerami można odliczyć bezpośrednio od struktury chemicznej.
Według Alkenes ten, który posiada najwięcej podstawników R, nabywa większą stabilizację podwójnej więzi. Zatem 1-buten jest najbardziej niestabilny, ponieważ ledwo ma podstawnik (-ch2Ch3); to znaczy jest monosustuido (rhc = cho2).
Izomery cis i trans 2-buten różnią się energią ze względu na napięcie ściany van der powstały przez efekt steryczny.
W izomerze CIS dwie grupy Ch3 Po tej samej stronie podwójnego wiązania odpychają się, podczas gdy w izomerze trans są one wystarczająco odległe od siebie.
Ale dlaczego 2-metylopropen jest najbardziej stabilnym izomerem? Ponieważ efekt elektroniczny wstawia.
W tym przypadku, chociaż jest to rozpuszczony alken, dwie grupy CH3 Są w tym samym węglu; w pozycji szlachetnej dotyczącej drugiego.
Grupy te stabilizują węgiel z podwójnym wiązaniem, nadając mu część ich chmury elektronicznej (ponieważ jest on stosunkowo bardziej kwaśny poprzez hybrydyzację SP2).
Ponadto w 2-butenu jego dwa izomery mają tylko 2. węglowodany; Podczas gdy 2-metylopropen zawiera trzeci węgiel, o większej stabilności elektronicznej.
Może ci służyć: struktura materiałów: koncepcja i przykładySiły międzycząsteczkowe
Stabilność czterech izomerów jest zgodna z logiczną kolejnością, ale to samo nie dzieje się w przypadku sił międzycząsteczkowych. Jeśli porównano ich temperatur.
Oczekiwano, że Trans-2-Buten przedstawi największe siły międzycząsteczkowe do większego kontaktu powierzchniowego między dwiema cząsteczkami, w przeciwieństwie do CIS-2-buten, którego szkielet przyciąga C. Jednak cis-2-buten gotuje się w wyższej temperaturze (3.7. c), że izomer trans (0.96º C).
Podobne punkty wrzenia dla 1-butenu i 2-metylopropenu oczekiwałyby ich, ponieważ są one strukturalnie bardzo podobne. Jednak w stanie stałym różnica zmienia się radykalnie. 1 -buten topi się do -185.3º C, podczas gdy 2 -metylopropen przy -140.4 c.
Ponadto izomer cis-2-buten topi się do -138.9º C, w temperaturze bardzo blisko 2-metylopropenu, co może oznaczać, że w stałej mają równie stabilne rozmieszczenie.
Na podstawie tych danych można stwierdzić, że pomimo znaczenia najbardziej stabilnych struktur, nie rzucają wystarczającej ilości światła na wiedzę o tym, jak siły międzycząsteczkowe działają w cieczy; A nawet więcej, w fazie stałej tych izomerów.
Buteenus używa
-Butenianie, biorąc pod uwagę ich ciepło spalania, mogą być po prostu wykorzystane jako źródło ciepła lub paliwa. Zatem można się spodziewać, że płomień 1-buten gorący bardziej niż płomień innych izomerów.
-Mogą być stosowane jako rozpuszczalniki organiczne.
-Służą jako dodatki do podniesienia poziomu oktanu benzyny.
-W syntezie organicznej 1-buten uczestniczy w produkcji innych związków, takich jak: tlenek butylenowy, 2-glutanol, sccynimida i terbutilmecaptano (używane do nadania gazowi kuchennego jego charakterystycznego zapachu).
Ponadto, od izomerów Butene, które można uzyskać Butadieno (Cho2= CH-CH = CH2), z której sztuczna guma jest syntetyzowana.
Oprócz tej syntezy różnorodność produktów będzie zależeć od tego, które cząsteczki są dodawane do podwójnego wiązania.
Na przykład halogenki alkilowe można zsyntetyzować, jeśli są reakcji z halogenami; alkohole, jeśli dodają wodę do kwaśnego pożywki; i trzecie butlery, jeśli dodają alkohole o niskiej masie cząsteczkowej (takie jak metanol).
Bibliografia
- Francis a. Szylkret. Chemia organiczna. Kwasy karboksylowe (wydanie szóste, strona 863-866). MC Graw Hill.
- Wikipedia (2018). Buteno. Zaczerpnięte: to jest.Wikipedia.org
- YPF (lipiec). Butenianie. [PDF]. Zaczerpnięte z: YPF.com
- William Reusch (2013). Reakcje dodawania alkes. Odzyskane z: 2.Chemia.MSU.Edu
- Pubchem (2018). 1-buten. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov

