Rozwiązanie nienasycone
- 4159
- 261
- Bertrand Zawadzki
 W nienasyconym roztworze połowa rozpuszczalnika jest nadal w stanie rozpuścić więcej substancji rozpuszczonej
W nienasyconym roztworze połowa rozpuszczalnika jest nadal w stanie rozpuścić więcej substancji rozpuszczonej Co to jest nienasycone rozwiązanie?
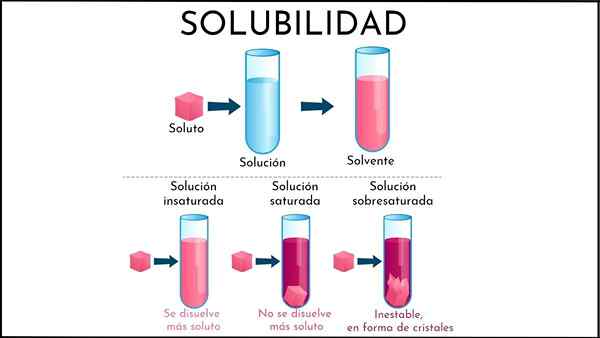
A Rozwiązanie nienasycone To wszystko to rozwiązanie, w którym medium rozpuszczalnika nadal jest w stanie rozpuścić więcej substancji rozpuszczonej. To medium jest na ogół ciekłe, chociaż może być również gazowe. Jeśli chodzi o substancję substancji rozpuszczonej, jest to konglomerat cząstek stałych lub gazowych.
A co z płynnymi substancjami substancji rozpuszczonych? W takim przypadku rozwiązanie jest jednorodne, o ile oba płyny są mieszalne. Przykładem tego jest dodanie alkoholu etylowego do wody; Dwie ciecze z ich cząsteczkami, Cho3Ch2Och i h2Lub są mieszkańcy, ponieważ tworzą mosty wodorowe (wybierz3Ch2Oh2).
Jeśli jednak diklorometan się miesza (wybierz2Cl2) i woda tworzyłyby roztwór z dwiema fazami: jeden wodny i drugi organiczny. To dlatego, że choles CH2Cl2 i H2Lub oddziałują bardzo słabo, więc niektórzy przesuwają się po pozostały.
Minimalna kropla Cho2Cl2 (substancja rozpuszczona) Wystarczająco na nasycenie wody (rozpuszczalnik). Gdyby, wręcz przeciwnie, mogliby utworzyć nienasycone rozwiązanie, widać całkowicie jednorodne rozwiązanie.
Z tego powodu tylko solidne i gazowe substancje rozpuszczone mogą generować nienasycone rozwiązania.
Co to jest nienasycone rozwiązanie?
W nienasyconym roztworze cząsteczki rozpuszczalnika oddziałują ze skuteczności.
Oznacza to, że interakcje rozpuszczalnikowe przekraczają, biorąc pod uwagę warunki ciśnienia i temperatury, interakcje rozpuszczone.
Po wzroście interakcji rozpuszczonych w rozpuszczonym „zorganizują” tworzenie drugiej fazy. Na przykład, jeśli pożywka rozpuszczalnikowa jest cieczą, a substancja substancji substancji stała, druga rozpuści się w pierwszym, aby utworzyć homogeniczny roztwór, dopóki nie pojawi się faza stała, która jest niczym więcej niż wytrącona substancja rozpuszczona.
Może ci służyć: polimetylogetacrylanTen osad wynika z faktu, że cząsteczki substancji rozpuszczonej udaje się pogrupować według ich chemicznego charakteru, nieodłącznie z ich strukturą lub powiązaniami. Kiedy tak się dzieje, mówi się, że rozwiązanie jest nasycone substancją rozpuszczoną.
Dlatego nienasycony roztwór substancji rozpuszczonej składa się z fazy ciekłej bez osadu. Podczas gdy substancja rozpuszczona jest gazowa, to nienasycone roztwór musi być wolne od obecności bąbelków (które są niczym więcej niż klastrami napojów bezalkoholowych).
Efekt temperatury
Temperatura bezpośrednio wpływa na stopień nienasycenia roztworu w odniesieniu do substancji rozpuszczonej.
Może to wynikać głównie z dwóch powodów: osłabienia interakcji rozpuszczonych z powodu efektu cieplnego oraz wzrost wibracji molekularnych, który pomaga rozproszyć cząsteczki substancji rozpuszczonej.
Jeśli podłoże rozpuszczalnika jest uważane za zwartą przestrzeń, w której otwory znajdują się cząsteczki substancji rozpuszczonej, temperatura zwiększa cząsteczki wibrowały zwiększenie wielkości tych otworów; w taki sposób, że substancja rozpuszczona może dotrzeć do innych kierunków.
Nierozpuszczalne substancje stałe
Jednak niektóre substancje rozpuszczone mają tak silne interakcje, że cząsteczki rozpuszczalnika ledwo są w stanie je oddzielić.
Kiedy tak jest, minimalne stężenie wspomnianej rozpuszczonej substancji rozpuszczonej jest wystarczające do wytrącania się, a następnie jest nierozpuszczalne stałe.
Nierozpuszczalne ciała stałe, tworząc drugą fazę stałą, która różni się od fazy ciekłej, generują niewiele nienasyconych roztworów.
Na przykład, jeśli 1L cieczy A może rozpuścić tylko 1 g B bez wytrącania się, to podczas mieszania 1L z 0 z 0.5 g B wygeneruje nienasycone rozwiązanie.
Może ci służyć: hydrocoloidPodobnie ranga stężeń w zakresie od 0 do 1 g B tworzy również nienasycone roztwory. Ale po 1G B wytrąca się. Kiedy to nastąpi, rozwiązanie przechodzi od nienasycania do nasyconego od B.
Jeśli nasycone roztwór z 1 jest poddane ogrzewaniu.5G B, ciepło pomoże w rozpuszczaniu osadu. Jeśli jednak jest dużo B wytrąconych, ciepło nie może go rozpuścić.
Jeśli tak, wzrost temperatury po prostu odparowałby rozpuszczalnik lub ciecz.
Przykłady nienasyconego rozwiązania
Przykłady nienasyconych rozwiązań są liczne, ponieważ zależą one od rozpuszczalnika i substancji rozpuszczonej. Na przykład dla tej samej cieczy A i innych substancji rozpuszczonych C, D, E… z, ich roztwory będą nienasycone, o ile nie wytrącą ani nie tworzą bańki (jeśli są gazowymi substancjami substancji rozpuszczonych).
-Morze może przyczynić się do dwóch przykładów. Woda morska jest masywnym roztworem ratunkowym. Jeśli zamierzasz gotować trochę tej wody, zostanie zauważone, że jest ona nienasycona przy braku wytrąconych soli. Jednak gdy woda odparowuje, rozpuszczone jony zaczynają być grupowane, pozostawiając Saltpeter przyklejoną do garnka.
-Innym przykładem jest rozpuszczanie tlenu w wodzie morza. Cząsteczka O2 Frank the Depth of the Sea na tyle, by oddychać faunę morską, chociaż jest ona mało rozpuszczalna.
Z tego powodu często obserwuje się pęcherzyki tlenu pojawiające się na powierzchni; z których kilka cząsteczek udaje się rozpuścić.
Podobna sytuacja występuje w przypadku cząsteczki dwutlenku węgla, co2. W przeciwieństwie do O2, Co2 Jest nieco bardziej rozpuszczalny, ponieważ reaguje z wodą z tworzeniem kwasu węglowego, h2WSPÓŁ3.
Może ci służyć: systemy materialneRóżnica z nasyconym roztworem
Podsumowując nowo wyjaśnione, jakie są różnice między nienasyconym i nasyconym roztworem? Po pierwsze, aspekt wizualny: nienasycone rozwiązanie składa się z pojedynczej fazy. Dlatego nie powinno być obecności stałej (fazy stałej) lub pęcherzyków (faza sody).
Również stężenia substancji rozpuszczonej w nienasyconym roztworze mogą się różnić, aż do powstania osad lub pęcherzyka. Podczas gdy w nasyconych roztworach dwufazowych (ciekło-gaza lub ciekło-gaza) stężenie rozpuszczonej substancji rozpuszczonej jest stałe.
Ponieważ? Ponieważ cząstki (cząsteczki lub jony), które tworzą osad, ustalają równowagę z tymi, które leżą rozpuszczone w rozpuszczalniku:
Cząstki osadu rozpuszczonych cząstek
Cząsteczki pęcherzyków rozpuszczone cząsteczki
Ten scenariusz nie jest rozważany w nienasyconych rozwiązaniach. Próbując rozpuścić większą substancję substancji rozpuszczonej w nasyconym roztworze, równowaga przesuwa się w lewo; do tworzenia większego osadu lub pęcherzyków.
Ponieważ w nienasyconych roztworach ta równowaga (nasycenie) nie została jeszcze ustalona (nasycenie) może „przechowywać” bardziej stałe lub gazowe.
Wokół glonów w dnie morskim jest rozpuszczony tlen, ale kiedy bąbelki tlenu rodzą się z jego liści, oznacza to, że występuje nasycenie gazu; W przeciwnym razie bąbelki nie byłyby obserwowane.
Bibliografia
- Chemia ogólna. materiały naukowe. Lima: Papieszczowy katolicki University of Peru. Odzyskany z: Korynta.PUCP.Edu.pe
- Helmestine, Anne Marie, pH.D. (2018). Definicja roztworu nienasyconego. Odzyskane z: Thoughtco.com
- Tutorvista (s.F.). Rozwiązanie nienasycone. Zaczerpnięte z: chemii.Tutorvista.com
- Chemistry Librettexts (s.F.). Rodzaje nasycenia. Odzyskane z: chem.Librettexts.org
- Nadine James. (2018). Rozwiązanie nienasycone: definicja i przykład. Odzyskane z: Study.com

