Struktura butanowa, właściwości, zastosowania i ryzyko
- 4155
- 334
- Arkady Sawicki
On Butanal Jest to aldehyd z otwartego łańcucha, składający się z czterech atomów węgla i jest analogiczny do butanu; W rzeczywistości jest to druga najbardziej utleniona postać węglowodorów butan. Jego wzorem molekularnym jest Cho3Ch2Ch2Cho, gdzie -cho jest grupą formilową.
Ten aldehyd, jeden z najlżejszych, składa się z przezroczystego, łatwopalnego i mniej gęstego cieczy niż woda. Ponadto jest rozpuszczalny w wodzie i mieszany z większością rozpuszczalników organicznych; Dlatego można go użyć do posiadania jedno -fazowych mieszanin organicznych.
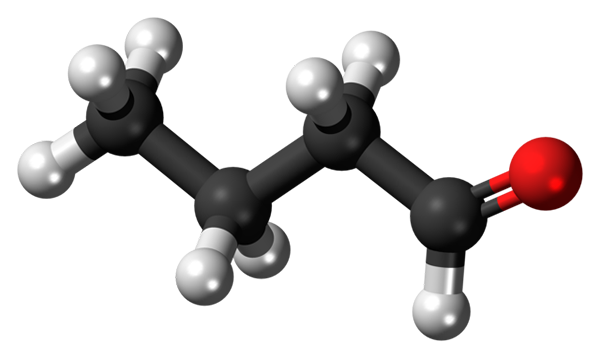
 Cząsteczka butanowa lub butialdehydu. Źródło: Jynto [CC0]
Cząsteczka butanowa lub butialdehydu. Źródło: Jynto [CC0] Obecność grupy karbonylowej (obecności czerwonej kuli, lepszego obrazu) daje chemiczną polarność cząsteczce butanalnej, a zatem zdolność do doświadczania interakcji dipol-dipolo między jej cząsteczkami; Chociaż między nimi nie powstają mosty wodoru.
To przynosi w konsekwencji, że Butanal przedstawia punkty wrzenia i fuzji większe niż Butan, ale mniej niż te przedstawione przez alkohol N-Boutyl.
Butanal jest używany jako rozpuszczalnik i jest pośrednikiem do uzyskania wielu produktów; takie jak akceleratory wulkanizacji gumów, żywic, produktów farmaceutycznych i agrochemicznych.
Butanal jest toksycznym związkiem, który wdychanie może powodować zapalenie górnych dróg oddechowych, oskrzeli i obrzęku płucnego, które nawet mogą mieć śmiertelne konsekwencje.
[TOC]
Struktura butanowa
Właśnie wspomniano, że grupa formilowa -ch. W wyniku tego ich cząsteczki mogą oddziaływać ze sobą przez siły dipolowe-dipolo.
Może ci służyć: suszarka do obrotowej: operacja, do czego jest, części, aplikacjeNa górnym obrazie pokazano, z modelem kul i prętów, że cząsteczka butanowa ma strukturę liniową. Group Carbon -cho ma hybrydyzację SP2, podczas gdy pozostałe węgle3.
Nie tylko to, ale jest również elastyczne, a ich linki mogą obracać się na własnych osiach; A zatem generowane są różne konformacje lub konformery (ten sam związek, ale z ich obróconymi linkami).
Conformeros
Poniższy obraz najlepiej wyjaśnia ten punkt:
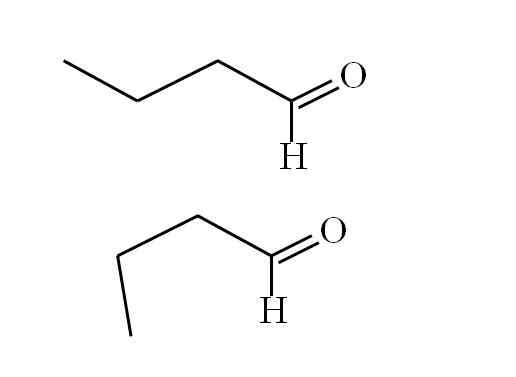 Butanal zgodny. Źródło: Gabriel Bolívar.
Butanal zgodny. Źródło: Gabriel Bolívar. Pierwszy konformator (wyższy) odpowiada cząsteczce pierwszego obrazu: grupy metylowej po lewej stronie, -ch3, i grupa -CO, są w pozycjach przeciw równoległym; jeden wskazuje odpowiednio, a drugi w dół.
Tymczasem drugi konformer (dolny) odpowiada cząsteczce z -ch3 i -Ho w przyćmonych pozycjach; to znaczy oba wskazują w tym samym kierunku.
Oba konformery są szybko wymienne, a zatem cząsteczka butanowa obraca się i stale wibruje; I dodał fakt, że ma stały dipol, to pozwala jego interakcjom na wystarczająco silne, aby zagotować przy 74,8ºC.
Nieruchomości
Nazwy chemiczne
-Butanal
-Butialdehyd
-1-butanalny
-Butiral
-N-butialdehyd.
Formuła molekularna
C4H8Lub Ch3Ch2Ch2Cho.
Wygląd fizyczny
Jest to wyraźna, przezroczysta płyn.
Zapach
Charakterystyczny zapach, akr, aldehyd.
Punkt wrzenia
167 ° F przy 760 mmHg (74,8 ° C).
Temperatura topnienia
-146 ° F (-96,86 ºC).
punkt zapłonu
-Zamknięte szkło 8 ºF (-22 ºC).
Rozpuszczalność wody
7 g/100 ml w 25 ° C.
Rozpuszczalność w rozpuszczalnikach organicznych
Mamiczne z etanolem, eterem, octanem etylu, acetonem, toluenem i wieloma innymi rozpuszczalnikami organicznymi.
Gęstość
0,803 g/cm3 w 68 ° F.
Może ci służyć: azotany: właściwości, struktura, nomenklatura, szkolenieGęstość pary
2,5 (w relacji powietrznej równa 1).
Ciśnienie pary
111 mmHg w 25 ° C.
Samokierunek
446 ° F. 425 ° F (21,8 ° C).
Breja
0,45 cpoise w 20 ° C.
Ciepło spalania
2479,34 kJ/mol w 25 ° C.
Ciepło parowe
33,68 kJ/mol w 25 ° C.
Napięcie powierzchniowe
29,9 dina/cm a 24 ºC.
Zapach próg
0,009 ppm.
Współczynnik załamania światła
1 3843 do 20 ° C.
Moment dipolarny
2,72 d.
Długości fali (λ) maksymalnej absorpcji w wodzie
225 nm i 282 nm (światło ultrafioletowe).
Polimeryzacja
Butanal może polimeryzować w kontakcie z alkalis lub kwasem, będąc niebezpieczną polimeryzacją.
Reaktywność
Po wystawieniu na powietrze utleniony, tworząc kwas masłowy. W temperaturze 230ºC butanal jest spontanicznie zapalny powietrza.
Kondensacja aldoliczna
Dwie cząsteczki butanowe mogą się na siebie reagować, w obecności KOH i temperatury 6-8 ° C, tworząc związek 2-etylo-3-hydroksyheksanol. Ten typ złożony nazywa się aldol, ponieważ ma grupę aldehydową i grupę alkoholową w swojej strukturze.
Synteza
Butanal może wystąpić przez katalityczne odwodornienie alkoholu n-butylowego; katalityczne uwodornienie crotonaldehydu; i hydroformlacja propylenu.
Aplikacje
Przemysłowcy
-Butanal jest rozpuszczalnikiem przemysłowym, ale jest również pośrednikiem w syntezie innych rozpuszczalników; na przykład 2-etylohekanol, n-butanol i trimetylopropan.
-Jest również stosowany jako pośrednik w opracowywaniu syntetycznych żywic, wśród nich policjil butiralu; akceleratory wulkanizacji gumy; produkcja produktów farmaceutycznych; produkty do ochrony upraw; pestycydy; przeciwutleniacze; Asystenci zmęczenia.
-Butanal jest używany jako surowiec do opracowania syntetycznych aromatów. Ponadto jest stosowany jako środek aromatyzujący żywność.
Może ci służyć: bromek sodu (NABR)Inni
-U człowieka Butanal jest stosowany jako biomarker wskazujący na uszkodzenie utleniania, doświadczane przez lipidy, białka i kwasy nukleinowe.
-Zastosowano go eksperymentalnie, wraz z formalnym i gluterdehydem, aby spróbować zmniejszyć zmiękczenie doświadczane przez hełmy wołowe, z powodu narażenia na wodę, mocz i kał bydła samego bydła. Wyniki eksperymentalne były pozytywne.
Ryzyko
Butanal jest destrukcyjny dla błon tkanek śluzowych górnych dróg oddechowych, a także tkanek skóry i oczu.
Przez kontakt ze skórą powoduje zaczerwienienie i oparzenia. W oczach wytwarzane są te same zmiany, które towarzyszą ból i uszkodzenie tkanki oka.
Wdychanie butanalne może mieć poważne konsekwencje, ponieważ może wytwarzać w krtani i zapaleniu i obrzęku oskrzeli; Podczas płuc wytwarza chemiczne zapalenie płuc i obrzęku płuc.
Znaki nadmiernej ekspozycji obejmują: odczucia zapałowe na górnych dróg oddechowych, kaszel, świszczący oddech, to znaczy emisja gwizdka podczas oddychania; zapalenie laryngur, brak oddechu, ból głowy, nudności, a także wymioty.
Wdychanie może być śmiertelne w wyniku skurczu dróg naprawczych.
Spożycie butanu powoduje uczucie „spalania” na ścieżkach trawiennych: jamie jamy ustnej, gardła, przełyku i żołądka.
Bibliografia
- Morrison, r. T. I Boyd, r. N. (1987). Chemia organiczna. (5ta Wydanie.). Redakcja Addison-Wesley Iberoamericana.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Pubchem. (2019). Butanal. Odzyskane z: Pubchem.NCBI.Nim.Nih.SZANOWNY PAN
- Wikipedia. (2019). Butanal. Odzyskane z: jest.Wikipedia.org
- Książka chemiczna. (2017). Butanal. Odzyskany z: chemicalbook.com
- Basf. (Maj 2017). N-butyraldehyd. [PDF]. Źródło: rozpuszczalniki.Basf.com

