Historia Boro, właściwości, struktura, użycia

- 3060
- 669
- Gabriela Łuczak
On bor Jest to element niemetaliczny, który kieruje grupą 13 tabeli okresowej i jest reprezentowany z symbolem chemicznym B. Jego liczba atomowa wynosi 5 i jest jedynym niemetalicznym elementem w jego grupie; Chociaż niektóre chemikalia uważają to za metaloid.
Jest przedstawiony jako czarno -brązowy proszek i jest w proporcji 10 ppm w odniesieniu do skorupy ziemskiej. Dlatego nie jest to jeden z najliczniejszych elementów.
 Próbka boro o czystości około 99%. Źródło: ALAJHASHA [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Próbka boro o czystości około 99%. Źródło: ALAJHASHA [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Jest częścią kilku minerałów, takich jak boraks lub boran sodu, jest to najczęstszy minerał boru. Istnieje również Kurnite, inna forma bwwru sodu; Boran colemanit lub wapniowy; oraz Ulexite, sod i wapń borato.
Boratos są ekstrahowane w Stanach Zjednoczonych, Tybecie, Chinach i Chile z światową produkcją około dwóch milionów ton rocznie.
Ten element ma trzynaście izotopów, będąc najbardziej obfitym jedenaścieB, który stanowi 80,1% boru i 10B, który stanowi pozostałe 19,9%.
Bor jest niezbędnym śladem dla roślin, interweniującego w syntezie niektórych ważnych białek roślinnych i przyczynia się do wchłaniania wody. U ssaków wydaje się konieczne dla zdrowia kości.
Chociaż bor został odkryty w 1808 roku przez angielskiego chemika Sir Humphry'ego Davy'ego, a francuscy chemicy Jacques Thérnard i Joseph Gay-Lussac, od początku naszej ery w Chinach był używany boraks w opracowaniu ceramiki emalii.
Bor i jego związki mają wiele zastosowań i zastosowań, od ich zastosowania w ochronie żywności, zwłaszcza margaryna i ryb, aż do zastosowania w leczeniu guzów raka mózgu, pęcherza, prostaty i innych narządów i innych narządów i innych narządów.
Bor nie jest bardzo rozpuszczalny w wodzie, ale jego związki są. Może to być mechanizm koncentracyjny boru, a także źródło zatrucia elementem.
[TOC]
Historia
Tło
Ponieważ Man Remote Times używał związków boru w różnych czynnościach. El Borax, minerał znany jako Tincal, był używany w Chinach w ciągu 300 dni.C. W opracowaniu szkliwa ceramiki.
Perski alchemik (865-925) pierwszą wzmiankę o związkach boro. Rhazes sklasyfikował minerały w sześciu klasach, z których jednym były borki, które obejmowały bor.
Agricola, około 1600 roku, zgłosił zastosowanie boraksu jako przepływu w metalurgii. W 1777 r.
Odkrycie elementu
Humphry Davy, poprzez elektrolizę roztworu boraksu, zaobserwował akumulację czarnego osadu w jednej z elektrod. Ogrzewał także tlenek boru (b2ALBO3) Z potasem, wytwarzając czarno -brązowy proszek, który był znaną formą boru.
Gay-Lussac i Thénard zmniejszyli kwas borowy w wysokich temperaturach w obecności żelaza do produkcji boru. Pokazali także proces odwrotny, to znaczy, gdzie kwas borowy jest produktem utleniania boru.
Identyfikacja i izolacja
Jöns Jakob Berzelius (1827) osiągnął identyfikację Boro jako nowego elementu. W 1892 r. Francuskiego chemika Henri Moissanowi udało się wyprodukować bor z 98% czystością. Chociaż wskazano, że Bor został wyprodukowany wyłącznie przez amerykańskiego chemika Ezechiela Weintrauba, w 1909 roku.
Nieruchomości
Opis fizyczny
Krystaliczny stały lub czarno-brązowy amorficzny proszek.
Może ci służyć: nadtlenki: właściwości, nomenklatura, zastosowania, przykładyMasa cząsteczkowa
10 821 g/mol.
Temperatura topnienia
2076 ºC.
Punkt wrzenia
3927 ºC.
Gęstość
-Ciecz: 2,08 g/cm3.
-Krystaliczny i amorficzny przy 20 ° C: 2,34 g/cm3.
Fusion Heat
50,2 kJ/mol.
Ciepło parowe
508 kJ/mol.
Pojemność kaloryczna trzonowa
jedenaście.087 J/(mol · k)
Energia jonizacji
-Pierwszy poziom: 800.6 kJ/mol.
-Drugi poziom: 2.427 kJ/mol.
-Trzeci poziom: 3.659,7 kJ/mol.
Elektronialiczność
2.04 na skali Pauling.
Radio atomowe
90 PM (empiryczne).
Objętość atomowa
4,16 cm3/mol.
Przewodność cieplna
27,4 W/m.K
Rezystancja
~ 106 Ω.M (w 20ºC).
Wysokie temperatury Bor jest dobrym przewodnikiem elektrycznym, ale w temperaturze otoczenia staje się prawie izolatorem.
Twardość
~ 9,5 w skali MOHS.
Reaktywność
Bor nie ma wpływu kwas hydrochlorowy w temperaturze wrzenia. Jest jednak przekształcany przez gorący kwas azotowy na kwas borowy (h (h3Bo3). Boro chemicznie zachowuje się jak nie -metal.
Reaguje ze wszystkimi halogenami, aby dać trihaluros, wysoce reaktywne. Mają one ogólną formułę Bx3, Gdzie x reprezentuje halogen.
Jest to połączone z kilkoma elementami, aby powstać boruros. Niektóre z nich należą do substancji o większej twardości; Na przykład azotek boru (BN). Bor jest połączony z tlenem z tworzeniem tritlesu boru.
Elektroniczna struktura i konfiguracja boru
Linki i jednostki strukturalne w boru
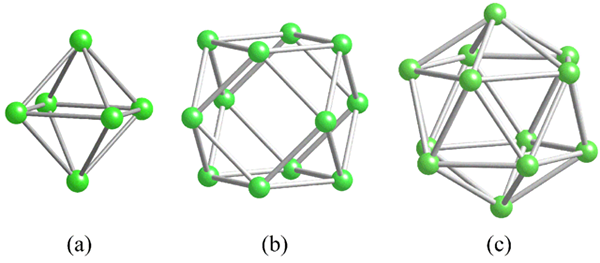 Geometrie wspólnych jednostek strukturalnych dla boru. Źródło: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Geometrie wspólnych jednostek strukturalnych dla boru. Źródło: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Przed zajęciem się strukturami boru (krystalicznego lub amorficznego) należy pamiętać o tym, jak można połączyć ich atomy. Link B-B jest w esencji kowalencyjnej; Nie tylko to, ale ponieważ naturalnie atomy boro mają niedobór elektroniczny, będą próbować dostarczyć go w swoje linki w taki czy inny sposób.
W boru znajduje się specjalny rodzaj wiązania kowalencyjnego: trzy centra i dwa elektrony, 3c2e. Tutaj trzy atomy boru mają dwa elektrony i definiują trójkąt, jedną z wielu twarzy znalezionych w ich strukturalnych wielościach (obraz doskonały).
Od lewej do prawej mamy: octaedro (a, b6), Cuboctaedro (b, b12) I izokazowe (c, b12 Również). Wszystkie te jednostki mają funkcję: są słabe w elektronach. Dlatego muszą łączyć kowalencyjnie między sobą; A rezultat jest zaskakującą imprezą linków.
W każdym trójkącie tych wielosedrów obecny jest link 3C2E. W przeciwnym razie nie można wyjaśnić, w jaki sposób bor, zdolny do tworzenia tylko trzech kowalencyjnych wiązań zgodnie z teorią łącza walencji, może mieć do pięciu linków w tych jednostkach wielościennych.
Struktury boru składają się następnie z układu i powtórzenia tych jednostek, które ostatecznie definiują kryształ (lub amorficzny stał).
BORO α-ROMBOédrico
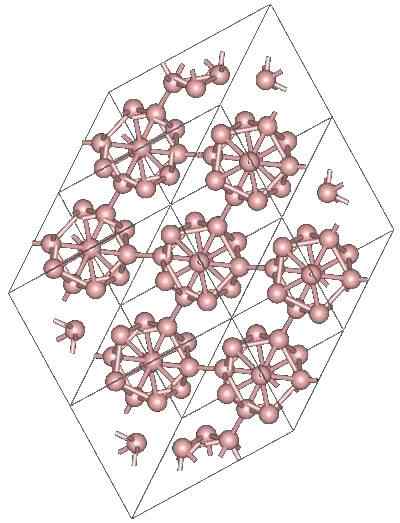 Krystaliczna struktura α-Romboédrico Bor alotropic. Źródło: MaterialScientist w angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Krystaliczna struktura α-Romboédrico Bor alotropic. Źródło: MaterialScientist w angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Mogą istnieć inne wielościenne jednostki boro, a także związek tylko przez dwa atomy, b2; „linia” boru, którą należy powiązać z innymi atomami po wysokim niedoborze elektronicznym.
Icosaedro jest zdecydowanie preferowaną jednością boru; Ten, który czuje się lepiej. Na przykład na górnym obrazie jest doceniane, w jaki sposób te jednostki B12 Przeplatają się, aby zdefiniować kryształ romboedralny boru-α.
Gdyby jeden z tych iCosaedros chciał zostać wyizolowany, byłoby to skomplikowane zadanie, ponieważ ich niedobór elektroniczny zmusza ich do zdefiniowania kryształu, w którym każdy z nich zapewnia elektrony, których potrzebują inni sąsiedzi.
Bor β-Romboédrico
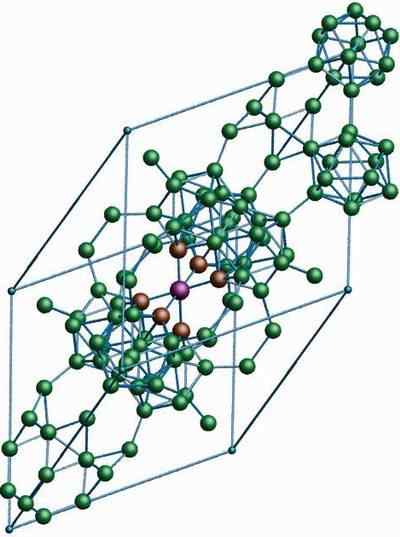 Krystaliczna struktura β-romboédrico boru alotropowego. Źródło: MaterialScientist w angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Krystaliczna struktura β-romboédrico boru alotropowego. Źródło: MaterialScientist w angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Bor β-Romboédrico alotropowy, jak wskazuje już jego nazwa, ma kryształy Rhomboédica, a także bor-α; Jednak różni się w swoich jednostkach strukturalnych. Wygląda jak pozaziemski statek wykonany z atomów boru.
Może ci służyć: wodorotlenek litu (lioh)Jeśli możesz uważnie zobaczyć jednostki ICOSAHEDRYCZNE w dyskretny i połączony sposób (w centrum). Istnieją również jednostki B10 i samotne atomy boru, które działają jak most dla wyżej wymienionych jednostek. Z tego wszystkiego jest to najbardziej stabilny boru.
BORO-γ GEMA
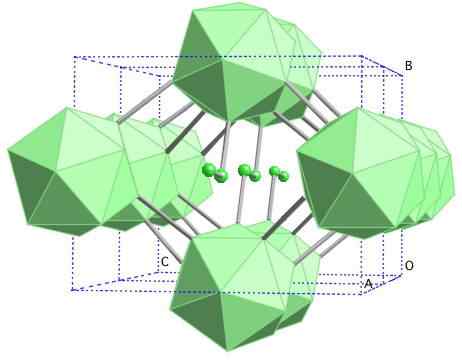 Krystaliczna struktura boru-γ. Źródło: MaterialScientist w angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Krystaliczna struktura boru-γ. Źródło: MaterialScientist w angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] W tym boru jednostki B są skoordynowane2 oraz b12. B2 przedstawia tyle niedoboru elektronicznego, że w rzeczywistości zdejmuje elektrony z B12 I zatem istnieje charakter jonowy w tej substancji stałej. Oznacza to, że nie tylko są kowalencyjnie zjednoczeni, ale istnieje przyciąganie elektrostatyczne [B2-] [B12+].
Boro-γ krystalizuje się w strukturze soli GEMA, tak samo jak w przypadku NaCl. Pozostają inne wyniesienia od boru do wysokiego ciśnienia (20 GPa) i temperatury (1800 ° C), a następnie pozostają stabilne w normalnych warunkach. Jego faktyczna stabilność konkuruje ze stabilnością boru β-romboédrico.
Sześcienne i amorficzne
Inne szczeliny boru składają się z agregatów atomów B, jakby były zjednoczone wiązaniem metalowym lub jakby były kryształami jonowymi; to znaczy, to bor sześcienny.
Również, a nie mniej więcej, jest amorficzny bor, którego rozmieszczenie jednostek B12 Jest przypadkowy i niechlujny. Jest prezentowany jako drobny lub szklisty proszek o ciemnych kolorach i nieprzezroczystym brązu.
Borofenos
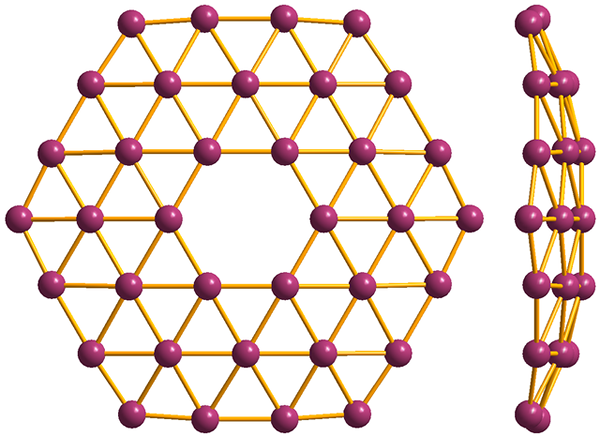 Struktura najprostszego z Borofenos, B36. Źródło: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Struktura najprostszego z Borofenos, B36. Źródło: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] I wreszcie jest najbardziej nowatorski i dziwny alotropowy z Boro: Borofenos (wyższy obraz). Składa się z małpy warstwy atomów boru; wyjątkowo cienki i analogiczny do grafenu. Zauważ, że zachowuje słynne trójkąty, charakterystyczne dla niedoboru elektronicznego, jaki cierpią.
Oprócz Borofenos, z których B36 Jest najprostszy i mały, są też klastry Boro. Borosferen (obraz poniżej) składa się z sferycznej klatki podobnej do kulki czterdziestu atomów Boro, b40; Ale zamiast mieć gładkie krawędzie, są nagle i nieregularne:
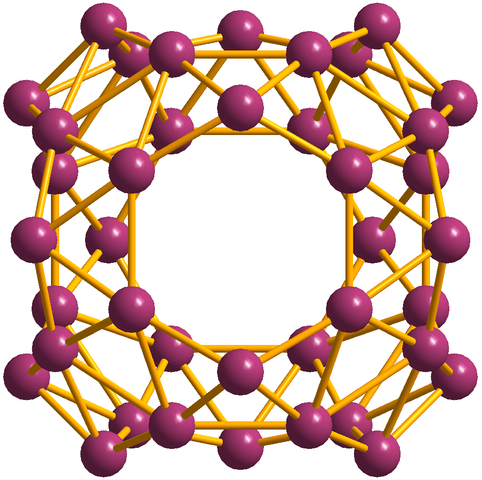 Borosferenos Unit, B40. Źródło: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Borosferenos Unit, B40. Źródło: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Elektroniczna Konfiguracja
Elektroniczna konfiguracja boru wynosi:
[On] 2s2 2 p1
Dlatego trzy elektrony z Walencji. Brakuje mu jeszcze pięciu, aby ukończyć swoje okteto w Walencji i ledwo utworzy trzy kowalencyjne więzi; Potrzebowałbym czwartego linku do celownika, aby ukończyć twój okett. Bor może stracić trzy elektrony, aby uzyskać stan utleniania +3.
Uzyskanie
Bor jest izolowany przez zmniejszenie kwasu borowego magnezem lub aluminium; Metoda podobna do gay-leussac i thénard. Ma trudności z zanieczyszczeniem boru z borurami tych metali.
Próbkę o wysokiej czystości można uzyskać przez gazową redukcję trichlorku boru lub tribromidu, z wodorem na elektrycznie ogrzewanych włókienach.
Bor o wysokiej czystości jest wytwarzany przez rozkład w wysokich temperaturach diborano, a następnie oczyszczanie procesów strefy lub czocharalski.
Aplikacje
W przemyśle
Bor żywiołowy zastosowano w hartowaniu stali. W stopie z żelazem, który zawiera od 0,001 do 0,005 % boru. Jest również stosowany w przemyśle niebędącym odchodem, zwykle jako deoksydant.
Ponadto bor jest używany jako błotnisty w stopach miedzianych i miedzi o wysokiej przewodności. W przemyśle półprzewodników dodawane są niewielkie ilości boro jako agent dopingowy krzemowej i germanów.
Może ci służyć: Isopreno: Struktura, właściwości, aplikacjeTlenek boro (b2ALBO3) jest mieszany z krzemionką, aby zrobić szklankę odporną na ciepło (szkło borosylianowe), stosowane w naczyniach kuchennych i niektórych sprzętach laboratoryjnych.
Carbide boro (b4C) Jest to niezwykle twarda substancja, która jest stosowana jako środek ścierny i wzmacniający w materiałach kompozytowych. Aluminium boruro (alb12) Jest stosowany jako diamentowy substytut mrożony i wypolerowany.
Boro jest używane w stopach, na przykład w magnesach ziem rzadkich, stopu z żelazem i neodymem. Utworzone magnesy są używane do produkcji mikrofonów, przełączników magnetycznych, słuchawek i akceleratorów cząstek.
W medycynie
Pojemność izotopu Boro-10 (10B) do złapania neutronów, emitujące promieniowanie typu α zastosowano do leczenia guzów mózgu w technice znanej jako terapia neutronowa boru (BNCT).
On 10B w postaci związków jest gromadzone w guza nowotworowym. Następnie promieniuje się strefą guza z neutronami. Te wchodzą w interakcje z 10B, co powoduje emisję cząstek α. Cząstki te mają wysoki względny efekt biologiczny i ze względu na ich duży rozmiar mają niewielki zasięg.
Tak więc niszczycielskie działanie cząstek α jest ograniczone w komórkach nowotworowych, wykonując ich zniszczenie. BNCT stosuje się również w leczeniu guzów szyi, wątroby, pęcherza i prostaty.
Działanie biologiczne
Niewielka ilość kwasu borowego lub boru w kształcie bwera jest konieczna do wzrostu wielu roślin. Niedobór boru przejawia się w zdeformowanym wzroście roślin; „brązowe serce” warzyw; i „sucha zgnilizna” buraków cukrowych.
Bor może być konieczny w małych ilościach, aby utrzymać zdrowie kości. Istnieją badania wskazujące, że brak boru byłby zaangażowany w generowanie zapalenia stawów. Interweniowałby również w funkcjach mózgu, takich jak pamięć i koordynacja wzroku.
Niektórzy eksperci wskazują, że 1,5 do 3 mg boru powinno być uwzględnione w diecie codziennej.
Ryzyko i ostrożność
Bor, tlenek boru, kwas borowy i boratos, są uważane za nietoksyczne. LD50 dla zwierząt wynosi 6 g boru/kg masy ciała, podczas gdy substancje o LD50 większe niż 2 g/kg masy ciała są uważane za nietoksyczne.
Z drugiej strony zużycie ponad 0,5 mg/dzień boru przez 50 dni powoduje niewielkie problemy trawienne, sugerując toksyczność. Niektóre doniesienia wskazują, że nadmiar spożycia boru może wpływać na funkcjonowanie żołądka, wątroby, nerek i mózgu.
Podobnie krótkoterminowe irytujące efekty wskazano w nosogardzieli, górnych dróg oddechowych i oczu do narażenia na bor.
Raporty o toksyczności boru są rzadkie, aw wielu przypadkach toksyczność jest prezentowana w bardzo wysokich dawkach, wyższa niż populacja ogólna jest narażona.
Zaleceniem jest monitorowanie treści boru w żywności, zwłaszcza warzyw i owoców. Rządowe agencje zdrowotne muszą monitorować, że koncentracja boru wody nie przekracza dozwolonych limitów.
Pracownicy narażeni na kurz zawierający bor powinni nosić maski, które chronią drogi oddechowe, rękawiczki i specjalne buty.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Alotropy boru. Źródło: w:.Wikipedia.org
- Prof. Robert J. Lancashire. (2014). Wykład 5b. Struktura elementów (nie-metal, B, C). Departament Chemii, University of the West Indies, Mona Campus, Kingston 7, Jamajka. Odzyskane z: chem.Uwiimona.Edu.JM
- Manisha Lalloo. (28 stycznia 2009). Odkryta struktura boru ultra-kure. Świat chemii. Odzyskane z: ChemistryWorld.com
- Bell Terence. (16 grudnia 2018 r.). Profil metalowego boru. Odzyskane z: balita.com
- Redaktorzy Enyclopaedia Britannica. (2019). BOR. Odzyskane z: Britannica.com
- Agencja ds. Substancji toksycznych i rejestrów chorób. (2010). Toxfaqs ™ na Bor. [PDF]. Źródło: ATSDR.CDC.Gov
- Helmestine, Anne Marie, pH.D. (6 lutego 2019). Właściwości chemiczne i fizyczne boru. Odzyskane z: Thoughtco.com

