Struktura biftalanu potasu, nomenklatura, zastosowania, ryzyko
- 4522
- 745
- Eliasz Dubiel
On Biftalan potasowy Jest to chemiczny, stały, biały, rozpuszczalny związek, który jest komercyjnie w stanie wysokiej czystości. Jest stosowany jako główny wzór do standaryzacji roztworów w kwalifikacjach kwasowo-zasadowych; Jest również stosowany jako rozwiązanie buforowe, aby utrzymać stabilne pH roztworów.
Jest to stabilny, niehygroskopowy związek, który ułatwia przygotowanie roztworu, ponieważ nie wchłania wody podczas ciężkiego procesu. Można go przygotować przez reakcję między kwasem fotograficznym a roztworem KOH, w którym wodór cząsteczki kwasu ftaliowego zastępuje się atomem potasu.
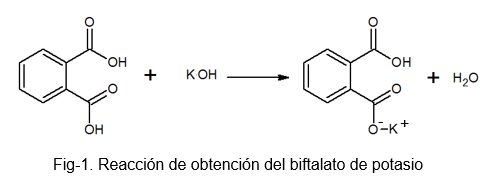
Biftalan potasu otrzymuje tę nazwę, ponieważ w swojej cząsteczce występuje lekko kwaśny wodór. Ten wodór jest tą znalezioną w grupie -OH, która znajduje się tuż obok grupy karbonylowej, która jest częścią karboksylu, która nie reaguje. Ten rodzaj soli jest znany jako sole kwasowe, ponieważ nie są całkowicie neutralne.
[TOC]
Struktura chemiczna

Formuła
C6H4Coohcook = c8H5 Ko4
Nomenklatura
- Biftalan potasowy.
- Ftalan kwasu potasu.
- Wodogrogatolan potasowy.
Nieruchomości
Gęstość
1636 g/ml.
Masa cząsteczkowa
204.22 g/mol.
Rozpuszczalność
Woda i alkohol.
Temperatura topnienia
295 ° C z rozkładem.
Aspekt
Biały -to -biały stał.
Dokładna waga
1,64 gr/cm3.
Badanie pochodne biftalanu potasu
Pomiary derichrograficzne wykazały, że rozkład biftalanu potasu rozpoczyna się między 190 ° C a 200 ° C, a niehygroskopowe przygotowanie można przygotować między 100 ° C a 150 ° C.
Rozkład przebiega w trzech etapach, których prędkość zależy od szybkości wzrostu temperatury: najpierw powstaje ftalan dipbotasowy, bezwodnik ftaliczny i woda są wyeliminowane.
Może ci służyć: chlorek wapnia (CACL2)Zmiany entalpía można również uzyskać z pochodnej, co daje informacje na temat dodatkowego mechanizmu rozkładu termicznego i zmian stanu próbki.
Zastosowania i aplikacje
Związek ten jest stosowany w chemii analitycznej w miareczkowaniu lub ocenie kwasowej jako główny wzór standaryzacji w przygotowaniu roztworów z różnych związków.
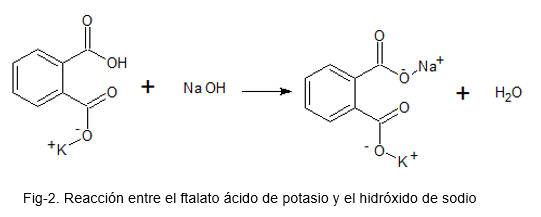
Standaryzacja podstawy (alkali = NaOH)
Podczas przygotowywania roztworu NaOH nie można zagwarantować, że stężenie, z jakim pozostaje rozwiązanie, jest prawidłowe; Wynika to z faktu, że NaOH jest bardzo higroskopową substancją stałą (wchłanianie powietrza z powietrza), a aby ją zważyć, pozostaje z pewną wilgocią, co sprawia, że ilość substancji nie jest najbardziej optymalną.
Po przygotowaniu rozwiązania należy dokładnie wiedzieć, jaka pozostała koncentracja.
W tym celu przygotowano roztwór z ftalanem kwasu potasowego, który jest pierwotnym wzorem (ze względu na jego wysoką stabilność); Dodano kilka kropli wskaźnika kwasu fenolftaleowego, a roztwór NaOH jako tytuł jest dodawany, aż kolorowy kolor będzie obecny w roztworze ftalanowym kwasu potasu.
Przy uzyskanych danych wprowadzane są odpowiednie obliczenia w celu znalezienia rzeczywistego stężenia NaOH.
Poniższy obraz ilustruje reakcję chemiczną między ftalanem kwasu potasowego a wodorotlenkiem sodu.

Jako roztwór bufora w oznaczaniu pH
Roztwór buforowy lub buforowy jest tym, który jest tworzony zarówno przez sól kwasową, jak i kwasową, co powoduje, że pozostaje on w warunkach, tak że wartość pH nie zmienia się, gdy dodaje się niewielkie ilości kwasu lub zasady.
Może ci służyć: grawimetria: analiza grawimetryczna, metody, zastosowania i przykładyRyzyko
- Ekspozycja na pożar. Podobnie jak w przypadku większości organicznych stałych, możliwe jest, że może wystąpić pożar w wysokich temperaturach lub przez kontakt ze źródłem zapłonu.
- Drobny pył rozproszony w powietrzu w wystarczających stężeniach i w obecności źródła zapłonu jest potencjałem niebezpiecznej eksplozji pyłu.
- Jest to stabilna substancja w temperaturze pokojowej i w odpowiednich warunkach przechowywania. Należy unikać nadmiernego ciepła i wilgoci.
- Może być niezgodny z silnymi utleniaczami, takimi jak kwas azotowy.
- Rozkład może tworzyć tlenki węglowe, które są toksyczne.
Dotyczące zdrowia
- Przez przypadkowe spożycie może powodować wymioty, biegunkę i podrażnienie w błonach.
- Przez wdychanie powoduje podrażnienie w drogach oddechowych i kaszel.
- W skórze powoduje podrażnienie.
- W oczach powoduje podrażnienie, zaczerwienienie i ból.
- Uważa się, że nie jest to substancja rakotwórcza, teratogenna ani mutagenowa.
Awaryjna i pierwsza pomoc
- Umyj oczy dużą ilością wody, usuń spowolnienie w przypadku ich noszenia i pozwolenie, by woda przebiegła przez oczy, nie dotykana rękami.
- Jeśli nastąpił kontakt ze skórą, usuń kostiumy i obuwie, umyj dużą ilością wody i umyj ubrania bardzo dobrze przed ponownym użyciem.
- W przypadku spożycia unikaj prowokowania wymiotów, wody pitnej.
- W przypadku inhalacji zabierz osobę do oddychania świeżego powietrza; W przypadku trudnego oddechu dostarczaj tlen.
- We wszystkich przypadkach zażądanie pilnej pomocy medycznej.
- W przypadku wycieków lub rozlania, zbierz produkt w czystym pojemniku i spróbuj, aby pył nie rozproszył się.
Może ci służyć: jakie są negatywne skutki z rozpuszczalności w wodzie?Środki ochrony osobistej
- Trzymaj się miejsca, w którym przechowywane są napoje, jedzenie i karma (karma dla zwierząt).
- Używaj masek przeciw kurzu, rękawice neoprenowe lub PVC. Obecnie stosuje się rękawiczki nitrylowe.
- Noś odpowiednie ubrania, które obejmują większość ciała, w tym zakryte buty lub buty i okulary bezpieczeństwa.
- Zalecana jest lokalna wentylacja spalin, z systemem ekstraktorów powietrza, biorąc pod uwagę główny kierunek wiatru.
- Produkt jest mieszany w wodzie, nie jest wchłaniany na ziemi, nie można go bioakumulacji ani biodegradowalne, nie oczekuje się, że wpłynie na życie wodne. Jednak w momencie jej odrzucenia należy to zrobić przy pomocy wyspecjalizowanego personelu: nie odrzucaj przez dreny.
- Przechowywać w pomarańczowej/zielonej okolicy, świeżego suchego i wentylowanego miejsca oraz oddzielone od niezgodnego materiału.
Bibliografia
- Merck (s.f), MerckMillipore.com
- Chang R.,(1992), Chemistry, (wydanie czwarte), Meksyk, McGraw-Hill Inter-American z Meksyku.A, z c.V
- Odczynniki chemii Meyer (S.f), arkusz danych bezpieczeństwa, biftalan potasowy, odzyskany z, Reagentsmeyer.com.MX
- Belcher, r.,Erdey, L.,Paulik, f.,LIPTAY.G.,(Lipiec 1960), Ogień wodorowa potasu, Scientedirect, Tom 5, wydanie 1, Strony 53-57, org/10.1016/0039-9140 (60) 80205-6

