Struktura sodu azyda (NAN3), właściwości, zastosowania, ryzyko

- 646
- 168
- Filip Augustyn
Azydku sodowego Jest to krystaliczna nieorganiczna substancja stała utworzona przez jon sodu na+ I Azida n jon3-. Jego formuła chemiczna jest nan3. Związek Nan3 Jest sól sodową kwasu hydrazoinowego HN3. Nan3 Jest to krystaliczna substancja stała bezbarwnie do białej.
Chociaż jest to bardzo toksyczny związek, jednym z jego najbardziej rozpowszechnionych miejsc pracy znajdowały się w poduszkach powietrznych, które są natychmiast zakażone podczas wypadków. Służy również do szybkiego nadmuchania slajdów awaryjnych samolotu. Jednak obecnie jego użycie jest bardzo kwestionowane w obu przypadkach pod kątem toksyczności.
 Sod nan azyd3 solidny. И.С. Непоконia [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Sod nan azyd3 solidny. И.С. Непоконia [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Jest stosowany w laboratoriach badawczych chemicznych do syntezy różnych rodzajów związków i w laboratoriach biochemicznych do badań z bakteriami, grzybami lub ssakami lub ludzkimi komórkami.
W niektórych laboratoriach służy do sterylizacji materiałów lub sprzętu, ale niektóre rodzaje mikroorganizmów są odporne.
Został również wykorzystany w rolnictwie do eliminowania pasożytów glebowych lub w branży drewna, aby zapobiec barwieniu drewna sosnowego grzybami.
[TOC]
Struktura
Sód azyda nan3 Jest tworzony przez kation sodu+ i azydowy anion n3-.
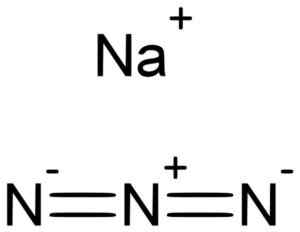 Sodum azyda jest tworzona przez sodowe na+ I Azida n jon3-. Lukáš Mižoch [domena publiczna]. Źródło: Wikimedia Commons.
Sodum azyda jest tworzona przez sodowe na+ I Azida n jon3-. Lukáš Mižoch [domena publiczna]. Źródło: Wikimedia Commons. Azida n jon3- Składa się z 3 atomów azotu (n) zjednoczonych przez siebie nawzajem wiązań kowalencyjnych, które mogą być proste, podwójne lub potrójne, ponieważ elektrony są dzielone między trzema.
Ten anion ma strukturę liniową, to znaczy trzy atomy azotu ułożone w linii prostej. Ponadto struktura jest symetryczna.
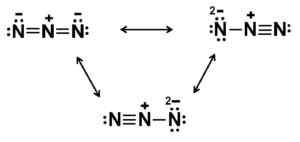 Możliwe struktury Lewisa anionu Azidy. Autor: Marilú Stea.
Możliwe struktury Lewisa anionu Azidy. Autor: Marilú Stea. Nomenklatura
- Azydku sodowego
- Sodu Azida
Nieruchomości
Stan fizyczny
Krystaliczne stałe bezbarwne do białego. Sześciokątne kryształy.
Waga molekularna
65,01 g/mol
Temperatura topnienia
Rozkłada się na 275 ° C.
Gęstość
1 846 g/cm3 w 20 ° C
Rozpuszczalność
Jest bardzo rozpuszczalny w wodzie: 41,7 g/100 ml w 17 ° C. Jest lekko rozpuszczalny w etanolu i nierozpuszczalny w eterze etylowym.
Stałe dysocjacji
Ma PKB 9.3. Wodne roztwory zawierają NH3, który szybko ucieka ze środowiska w temperaturze 37 ° C.
Właściwości chemiczne
Nan3 Jest bardzo żrący w stosunku do aluminium i umiarkowanie w kierunku miedzi i ołowiu.
Może ci służyć: walencje azotoweWedług określonego źródła, azid sodu nie jest wybuchowy. Rozkłada się delikatnie i całkowicie, gdy jest podgrzewany w temperaturze 300 ° C lub więcej, tworząc gaz sodu i azot2.
2 Nan3 → 2 Na + 3 N2↑
Jest to środek nizrorzenujący, oznacza to, że służy do azotu lub dodawania azotu do innych związków chemicznych lub do powierzchni materiałów, takich jak stal.
Jest stabilny w wodzie neutralnej lub alkalicznej przy braku światła. Rozkłada się przez promieniowanie słoneczne.
Właściwości biochemiczne
Azid sodu hamuje enzym zwany oksydazą cytochromu, który występuje w mitochondriach komórek i jest znacząco zaangażowany w oddychanie i wytwarzanie energii w tym.
Jego działanie zapobiega wytwarzaniu ATP z kluczowego związku w aktywności komórkowej, a komórka pogarsza się lub uszkadza.
Jeśli jest połknięty, wdychany lub kontakt z azydą sodu, jest bardzo toksyczny i może stać się śmiertelny.
Uzyskanie
NH amoniak reaguje3 Z metalowym sodio na w 350 °2.
Sód nanh2 Reaguje z tlenkiem dyitrogenowym n2Lub w 230 ° C w reaktorze niklu, a zatem powstaje mieszanka sodu nan3, Wodorotlenek sodu NaOH i amoniak NH3.
2 Nanh2 + N2O → Nan3 + NaOH + NH3
Można go również uzyskać przez reakcję amidu sodu z azotanem nano sodu3 w 175 ° C:
3 Nanh2 + Starszy brat3 → Nan3 + 3 NaOH + NH3
Aby oczyszczyć azid, do mieszaniny dodaje się wodę, kryształy azidów myje się, a następnie woda odparowuje. Krystaliczny materiał, który pozostaje3 to następnie wyschnie w temperaturze 110 ° C.
Aplikacje
W pojazdach silnikowych i samolotach
Azid sodu był szeroko stosowany w branży samochodowej jako generator azotu do szybkiego nadmuchania poduszek powietrznych (angielski Poduszki powietrzne) Bezpieczeństwo ulotek samochodowych i ciężarówek, gdy nastąpi wpływ.
Został również używany w nadmuchiwanych slajdach, które służą szybkiej ucieczki od wnętrza samolotów, które wylądowały w sytuacjach awaryjnych.
W obu przypadkach mechanizm obejmuje działanie iskier2 i tlenek sodu na2ALBO.
Może ci służyć: reakcja podwójnego podstawieniaTa aplikacja wymaga natychmiastowego uwalniania zimnego i nietechnicznego gazu, więc azot jest najbardziej odpowiednim gazem.
 Torby bezpieczeństwa, które były już używane w pojazdach. Autor: Marcel Langthim. Źródło: Pixabay.
Torby bezpieczeństwa, które były już używane w pojazdach. Autor: Marcel Langthim. Źródło: Pixabay. Jednak to zastosowanie zmniejsza się z powodu toksyczności azydów sodu i zamiast tego jest używane mniej toksyczne związki.
W przemyśle chemicznym
Jest stosowany jako opóźniacz w produkcji gumy do gąbek, aby zapobiec krzepnięciu stretch lub lateksu butadienu, gdy są przechowywane w kontakcie z metalem i do rozkładu azotynów w obecności azotanów.
W rolnictwie
Został użyty w rolnictwie: Jako biorka i fumigant, to także nematyd, to znaczy stosuje się w glebach w celu wyeliminowania nicieni, które są pasożytami atakującymi niektóre uprawy.
 Uszkodzenia spowodowane nicieniami u podstawy rośliny. Autor: Redwolf. [http: // www.Ars-grin.Gov/ARS/Soatlantic/FP/STPP/Burelle/Burelle.html] Źródło: Wikimedia Commons.
Uszkodzenia spowodowane nicieniami u podstawy rośliny. Autor: Redwolf. [http: // www.Ars-grin.Gov/ARS/Soatlantic/FP/STPP/Burelle/Burelle.html] Źródło: Wikimedia Commons. Działa również jako herbicyd i unikać gnicia owoców.
Ostatnio NAN3 Zastosowano go w przygotowaniu nasion okry lub quimbombó, aby obserwować jego odporność na wodę wodociągową.
Nasiona, do których wcześniej zastosowano NAN3 Wygenerowały sadzonki, które lepiej wycofały warunki powodziowe niż nieuzasadnione, poprawiły wysokość roślin, zwiększyli liczbę liści i zwiększyli ilość korzeni nawet przy nadmiarze wody.
W przygotowaniu innych związków chemicznych
Jest stosowany jako odczynnik chemiczny w syntezie związków organicznych, na przykład w celu przygotowania wielu organicznych azydków, takich jak trzeciorzędowa azydki grupy alkilowej, które są ważne w syntezie chemicznej.
Służy do przygotowania kwasu hydrazoesowego (HN3) i czysty sód (NA).
W branży wybuchowej
Sód azyda nan3 Jest pośrednikiem w produkcji wybuchowej, ponieważ jest wykorzystywany do przygotowania ołowiu azid3)2. Ten ostatni jest związek, który eksploduje po silnym pobiciu, więc jest stosowany w konstrukcji urządzeń detonacyjnych.
 Sód azyda nan3 Służy do produkcji ołowiu PB (n3)2 związek, który jest częścią urządzeń do generowania eksplozji. Autor: OpencLipart-Vectors. Źródło: Pixabay.
Sód azyda nan3 Służy do produkcji ołowiu PB (n3)2 związek, który jest częścią urządzeń do generowania eksplozji. Autor: OpencLipart-Vectors. Źródło: Pixabay. W laboratoriach biochemicznych
Azid sodu jest stosowany, gdy wymagany jest sterylny sprzęt laboratoryjny, ponieważ jest on w stanie zniszczyć różne rodzaje mikroorganizmów.
Może ci służyć: kwas przysadki (H3PO2): właściwości, zastosowania i odczynnikiJest to czynnik biobójczy. Jednak niektóre źródła wskazują, że niektóre rodzaje bakterii są odporne na ich działanie.
Osiąga się to poprzez blokowanie miejsca wiązania tlenu w cytochromie oksydazy, który jest enzymem zaangażowanym w proces produkcji energii niektórych mikroorganizmów.
Jest stosowany w automatycznych licznikach krwi, również w różnicowej selekcji bakterii i do zachowania roztworów odczynników laboratoryjnych, ponieważ zapobiega wzrostowi niektórych mikroorganizmów.
W kilku zastosowaniach
Sodium Azida służy w branży drewnianej, aby uniknąć wzrostu brązowych plam grzybów na drewnie sosnowym.
Został również wykorzystany w japońskim przemyśle piwowym, aby uniknąć rozwoju grzyba, który ciemnieje.
Ryzyko
Azid sodu jest toksycznym związkiem, który hamuje ważny enzym do oddychania i życia komórek ludzkich i zwierząt. Stwierdzono, że może poważnie wpłynąć na komórki tkanki komórkowej naczynia krwionośnego mózgu.
Jego natychmiastowym działaniem po spożyciu, wdychaniu lub kontaktowi skóry jest niebezpieczne obniżenie ciśnienia krwi, co może prowadzić do śmierci. Dlatego należy go manipulować z wielką ostrożnością.
Istnieją źródła informacji, które przyciągają uwagę na poduszki powietrzne pojazdów, które są zniszczone na podstawie odpadów.
W takich przypadkach osoby, które nie wiedzą, że niebezpieczeństwo mogą uzyskać dostęp do depozytów NAN3, To jest bardzo toksyczny związek. Ponadto istnieje niebezpieczeństwo zanieczyszczenia NAN3 Gleba i wody.
Podobnie, podczas wypadków, zderzenia lub pożarów pojazdów ludzie mogą być narażone na NAN3 I może to być niedoceniane lub nieznane przez personel medyczny uczestniczący w nagłych wypadkach.
Zwrócono również uwagę na wystawę personelu laboratoryjnego, który go używa.
Bibliografia
- Vwioko, e.D. i in. (2019). Primowanie azydku sodu zwiększa tolerancję stresu w okra (Abelmoschus esculentus). Agronomy 2019, 9, 670. MDPI odzyskało.com.
- Kho, d.T. i in. (2017). Śmierć bariery śródbłonkowej bariery krwi na azydkę sodu i jej produkty gazowe. Biosensors 2017, 7, 41. MDPI odzyskało.com.
- LUB.S. National Library of Medicine. (2019). Azydku sodowego. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov.
- Talavera, m. i in. (2019). Zarządzanie nicieniami na polach truskawkowych w południowej Hiszpanii. Agronomy 2019, 9, 252. MDPI odzyskało.com.
- Okano, t. i in. (1995). Mechanizm oderwania komórek z modulowanej temperatury, hydrofilowo-hydrofobowych powierzchni polimerowych. W biomateriałach: srebrne jubileuszowe kompendium. Odzyskane z naukowym.com.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). PIĄTA EDYCJA. Tom A22. VCH Verlagsgellschaft MBH.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Chang, s. i Lamm, s.H. (2003). Efekty ekspozycji na azydek sodu w ludziach: przegląd i analiza literatury. Int J Toxicol 2003, 22 (3): 175-86. NCBI odzyskało.NLM.Nih.Gov.
- « Wszystkiego najlepszego z okazji urodzin najlepsze frazy do dedykowania
- 105 zwrotów dla niewiernych mężczyzn i kobiet »

