Historia arsenu, struktura, właściwości, użycia

- 2222
- 319
- Pani Waleria Marek
On arsen Jest to półmetal lub metaloidowy, który należy do grupy 15 lub przechodzi z układu okresowego. Jest reprezentowany przez symbol chemiczny jako i ma atomową liczbę 33. Może być poniżej trzech alotropowych form: żółty, czarny i szary; Ten ostatni ma jedyne znaczenie przemysłowe.
Szary arsen jest metalicznym, kruchym stałym, o stalowym i krystalicznym kolorze (niższy obraz). Traci swoją jasność po wystawieniu na powietrze tworzące tlenek arsenoso (jak2ALBO3), który po podgrzaniu emituje zapach czosnku. Z drugiej strony jego żółte i czarne alotrochos są odpowiednio molekularne i amorficzne.
 Metalowy arsen. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]
Metalowy arsen. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] Arsen znajduje się w skórce Ziemi związanej z wieloma minerałami. Tylko niewielka część jest w stanie natywnym, jednak związany z antymonem i srebrem.
Wśród najczęstszych minerałów, w których arsen jest następujący: Rejalgar (jak4S4), Oropiment (jak2S3), Loellingita (brzydka2) i enargita (cu3Tyłek4). Arsen jest również uzyskiwany jako produkt zabezpieczenia odlewni metali, takich jak ołów, miedź, kobalt i złoto.
Związki arsenowe są toksyczne, zwłaszcza Arsina (popiół3). Jednak Arsenic ma wiele zastosowań przemysłowych, w tym stop z ołów, stosowany w opracowywaniu akumulatorów samochodowych, a stop z galem z kilkoma zastosowaniami w elektronice.
[TOC]
Historia twojego odkrycia
Nazwa „arsenu” pochodzi od łacińskiego arsenu i greckiego arsenikonu, odnoszący się do żółtego oropimentu, który stanowi główną formę użycia arsenu przez alchemików.
Arsen na długo przed rozpoznaniem jako element chemiczny był znany i stosowany w postaci jego związków. Na przykład Arystoteles w czwartym wieku.C. Pisał o Sandarache, substancji, która teraz uważa się, że była to siarczk arsenowy.
Plino El Viejo i Pivanio Disclorides w II wieku.C., Opisali oropiment, minerał utworzony przez2S3. W XI wieku rozpoznano trzy gatunki arsenu: białe (jak4ALBO4), Żółty (jak2S3) i czerwony (jak4S4).
Arsen jako czysty element zaobserwował po raz pierwszy Albertus Magnus (1250). Magnus podgrzewał siarczk arsenowy z mydłem, zauważając pojawienie się substancji o charakterystyce podobnej do szarego obrazu obrazu obrazu. Jednak pierwszy autentyczny raport z jego izolacji został opublikowany w 1649 r. Przez Johanna Schroedera, niemieckiego farmaceuty.
Schroeder przygotował arsen poprzez podgrzewanie tlenku węgla. Następnie Nicolas Lémery udało się go podgrzać, ogrzewając mieszaninę tlenku arsenu, mydła i potasu. W XVIII wieku element ten został ostatecznie uznany za semimetal.
Może ci służyć: bez elektrolitów: cechy i przykładyStruktura arsenu
Arsen jest izomorficzny do antymonu; To jest strukturalnie identyczne, różnią się tylko wielkością ich atomów. Każdy atom arsenu tworzy trzy kowalencyjne wiązania, w taki sposób, że pochodzą one również jednostki sześciokątne6 „Pomarszczone lub strome”, ponieważ hybrydyzacja jako atom3.
Następnie jednostki6 Łączą się, powodując strome warstwy arsenu, które słabo ze sobą oddziałują. Po ich siłach międzycząsteczkowych, zależnych głównie od ich mas atomowych, szary arsenowy rhomneniczny kryształy nadają ciałowi kruchą i kruchą teksturę.
Prawdopodobnie z powodu odpychania elektronów arsenowych, jednostki6 Utworzone między warstwami równoległymi nie definiują idealnego oktaedronu, ale zniekształcone:
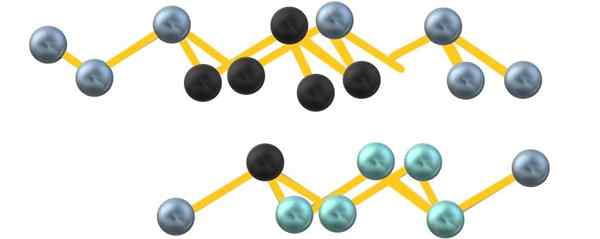 Szara arsenowa struktura krystaliczna. Źródło: Gabriel Bolívar.
Szara arsenowa struktura krystaliczna. Źródło: Gabriel Bolívar. Zauważ, że czarne kule rysują zniekształconą płaszczyznę w przestrzeni między dwiema stromymi warstwami. Również w warstwie poniżej znajdują się niebieskawe kule, które obok czarnej kuli tworzą urządzenie6 wspomniane na początku sekcji.
Struktura wygląda na uporządkowaną, wiersze rosną i spadają, a zatem jest krystaliczne. Możesz jednak stać się amorficzny, z wyciśniętymi sferami na różne sposoby. Kiedy szary arsen staje się amorficzny, staje się półprzewodnikiem.
Żółty arsen
Żółty arsen, najbardziej toksyczny alotropowy tego elementu, jest jedynie stałą molekularną. Składa się z jako cząsteczki4 jednostki przez słabe siły dyspersji, które nie uniemożliwiają im uiękowania.
Czarny arsen
Czarny arsen jest amorficzny; Ale nie jak może być szarawo. Jego struktura jest nieco podobna do ostatniego6 Mają większe obszary i różne wzorce zaburzeń.
Elektroniczna Konfiguracja
[AR] 3D104s24p3
Ma wszystkie orbitale poziomu 3. Forma łączy przy użyciu orbitali 4s i 4p (a także 4D) według różnych hybrydyzacji chemicznych.
Nieruchomości
Waga molekularna
74 922 g/mol
Opis fizyczny
Szary arsen jest szarawo wyglądającym metalicznym stałym i kruchą konsystencją.
Kolor
Trzy formy alotropowe, żółty (alfa), czarny (beta) i szary (gamma).
Zapach
Toaleta
Smak
Bez smaku
Temperatura topnienia
1.090 K przy 35,8 atm (Triple Arsenic Point).
Przy normalnym ciśnieniu nie ma punktu fuzji, ponieważ sublimuje 887 K.
Gęstość
-Szary arsen: 5,73 g/cm3.
Może ci służyć: grupa karbonylowa: charakterystyka, właściwości, nomenklatura, reaktywność-Żółty arsen: 1,97 g/cm3.
Rozpuszczalność wody
Nierozpuszczalny
Radio atomowe
139 PM
Objętość atomowa
13.1 cm3/mol
Radio Kowalencyjne
120 PM
Ciepło właściwe
0,328 J/g · mol w 20 ° C
Ciepło parowania
32,4 kJ/mol
Elektronialiczność
2,18 na skali Paulinga
Energia jonizacji
Pierwsza energia jonizacji 946,2 kJ/mol
Stany utleniania
-3, +3, +5
Stabilność
Arsen żywiołowy jest stabilny w suchym powietrzu, ale gdy jest wystawiony na wilgotne powietrze, jest pokryty warstwą żółtej brązu, która może stać się czarną warstwą tlenku arsenu (2ALBO3).
Rozkład
Kiedy arsen jest podgrzewany do rozkładu, emituje biały dym z AS2ALBO3. Procedura jest niebezpieczna, ponieważ Arsina może być również emitowana, bardzo trujący gaz.
Samokierunek
180 ° C
Twardość
3.5 w skali twardości MOHS.
Reaktywność
Nie jest atakowany przez zimny kwas siarkowy lub stężony kwas solny. Reaguje z kwasem azotowym lub gorącym kwasem siarkowym, tworząc kwas arsenowy i kwas arsenowy.
Gdy szary arsen jest ulatniony przez ogrzewanie, a opary są szybko chłodzone, powstaje żółty arsen. Powraca to do szarawego kształtu, gdy jest poddawany światłem ultrafioletowym.
Aplikacje
Stopy
Niewielka ilość arsenu dodana do ołowiu, stwardniał jego stopy, aby używać ich w podszewce kabli oraz w opracowaniu akumulatorów samochodowych.
Dodanie arsenu do mosiądzu, stopu miedzi i cynku, zwiększa jego odporność na korozję. Z drugiej strony, koryguje lub zmniejsza utratę cynku w mosiądzu, co powoduje wzrost jego użytkowania.
elektronika
Oczyszczony arsen jest stosowany w technologii półprzewodnikowej, w której jest stosowany w połączeniu z galijskim.
GAA mają bezpośredni przedział pasmowy, który można zastosować w produkcji diod, lasera i diody LED. Oprócz galu arseniuro istnieją inne arseniury, takie jak Indian Arseniuro i aluminium arseniuro, które stanowią również półprzewodniki II-V.
Tymczasem kadm arseniuro jest półprzewodnikiem typu II-IV. Arsina była używana w domieszkowaniu półprzewodników.
Rolnictwo i ochrona drewna
Większość zastosowań została odrzucona ze względu na ich wielką toksyczność i ich związki. As2ALBO3 był używany jako pestycyd, podczas gdy as2ALBO5 Jest to składnik herbicydów i środków owadobójczych.
Kwas arsenowy (h3Aso4) i sole, takie jak wapń i arsenian ołowiu, zostały użyte do sterylizacji gleb i szkodników kontrolnych. To generuje ryzyko zanieczyszczenia środowiska za pomocą arsenu.
Może ci służyć: płynne elementy: jakie są i przykładyOłów arseniato był używany jako owadobójca w drzewach owocowych, aż do pierwszej połowy XX wieku. Ale ze względu na jego toksyczność zastąpiono go metylararsennianem sodu, który przestał być używany z tego samego powodu od 2013 roku.
Leczniczy
Do XX wieku kilka ich związków stosowano jako leki. Na przykład arsfenamina i neolsalvarsan zastosowano w leczeniu kiły i triposomiwy.
W 2000 r. Zastosowanie AS zostało zatwierdzone2ALBO3, Bardzo toksyczny związek, w leczeniu ostrego opornego na prowizor obiecujące. Niedawno zastosowano radioaktywny izotop 74Jeśli chodzi o lokalizację guzów.
Izotop wytwarza dobre obrazy, wyraźniejsze niż te uzyskane z 124Ja, ponieważ jod jest zabierany na tarczycę i wytwarza szum w sygnał.
Inne zastosowania
Arsen był używany w przeszłości jako dodatek do produkcji drobiu i świń.
Jest stosowany jako katalizator w produkcji tlenku etylenu. Jest również stosowany w pirotechnika i opalenizny. Tlenek arsenioso jest stosowany jako odbarwienie w produkcji szklanych.
Gdzie to się znajduje?
Arsen można znaleźć w niewielkich ilościach w stanie podstawowym, z wysokim stopniem czystości. Jest obecny w licznych związkach, takich jak: siarki, arsenuros i sulfarsomuros.
Występuje również w kilku minerałach, w tym: arsenopirytu (FESA), Loellingita (brzydka2), enargita (cu3Tyłek4), Oropiment (jak2S3) I Rejalgar (jak4S4).
Jak to jest uzyskiwane?
Arsenopirita jest ogrzewana do 650-700 ° C, przy braku powietrza. Arsen odparowuje, pozostawiając siarczek żelaza (FES) jako pozostałość. Podczas tego procesu arsen wiąże się z tlenem4ALBO6, znany jako „biały arsen”.
As4ALBO6 Jest modyfikowany, aby utworzyć AS2ALBO3, którego opary są zbierane i skondensowane w zestawie ceglanych kamer, oczyszczając arsen przez sublimację.
Większość arsenu jest wytwarzana przez zmniejszenie węgla kurzu utworzonego z2ALBO3.
Bibliografia
- Stephen R. Marsden. (23 kwietnia 2019). Chemia arsenu. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Helmestine, Anne Marie, pH.D. (3 grudnia 2018 r.). Ciekawe fakty dotyczące arsenu. Odzyskane z: Thoughtco.com
- Wikipedia. (2019). Arsen. Źródło: w:.Wikipedia.org
- Dr. Ciasto Stewart. (2019). Fakty elementów arsenu. Chemicool. Odzyskane z: Chemicool.com
- Royal Society of Chemistry. (2019). Arsen. Odzyskane z: RSC.Lub
- Redaktorzy Enyclopaedia Britannica. (3 maja 2019 r.). Arsen. Encyclopædia Britannica. Odzyskane z: Britannica.com
- « Charakterystyka mniejszości grupy, typy, przykłady
- Reynolds numer Po co to jest, jak jest obliczane, ćwiczenia »

