Antraceno, co jest, struktura, właściwości, używa
- 770
- 135
- Paweł Malinowski
On Antracen Jest to wielopierścieniowe węglowodory aromatyczne (PAH), które powstaje przez fuzję trzech pierścieni benzenowych. Jest to bezbarwny związek, ale pod napromieniowaniem światła ultrafioletowego nabiera fluorescencyjnego niebieskiego koloru. Antraceen łatwo sublimuje.
Jest to biała substancja stała, ale może również wystąpić jako nieskliniczne bezbarwne kryształy, z miękkiego aromatycznego zapachu. Stały antraceń jest praktycznie nierozpuszczalny w wodzie i jest częściowo rozpuszczalny w rozpuszczalnikach organicznych, szczególnie w disiarczku węgla, CS2.
Został odkryty w 1832 r. Przez sierpień Laurent i Jean Dumas, używając smoły jako surowca. Materiał ten jest nadal stosowany w produkcji antracenu, ponieważ zawiera 1,5 % związku aromatycznego. Można go również zsyntetyzować z benzochinonu.
Znajduje się w środowisku jako produkt częściowego spalania węglowodorów kopalnych. Znaleziono go w wodzie pitnej, w powietrzu atmosferycznym, w ucieczce pojazdów silnikowych i w dymie papierosów. Pojawia się na liście EPA (Agencja Ochrony Środowiska Stanów Zjednoczonych) najważniejszych zanieczyszczeń środowiskowych.
Struktura antracena
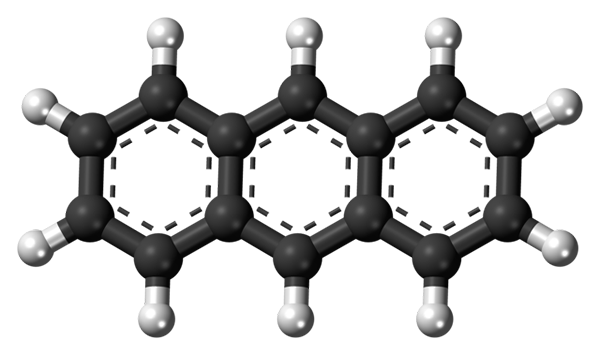 Trzy aromatyczne pierścienie antracenu. Źródło: Jynto [CC0]
Trzy aromatyczne pierścienie antracenu. Źródło: Jynto [CC0] Górny obraz pokazuje strukturę antracenu reprezentowanego za pomocą modelu sfery i słupków. Jak widać, istnieją trzy sześciokrębowe pierścienie aromatyczne; To są pierścienie benzenowe. Kropkowane linie wskazują aromatyczność obecną w strukturze.
Wszystkie węgle mają hybrydyzację SP2, Więc cząsteczka jest w tej samej płaszczyźnie. Dlatego antraceń można uznać za mały i aromatyczny arkusz.
Zauważ, że atomy wodoru (białe kule) są praktycznie odkryte przed szeregiem reakcji chemicznych.
Siły międzycząsteczkowe i struktura krystaliczna
Anthracen. Na przykład widać, że dwa z tych „arkuszy” łączą się i poruszają elektrony ich chmury π (aromatyczne centra pierścieni), udaje im się utrzymać razem.
Inną możliwą interakcją jest to, że hydrogeny o pewnym dodatnim obciążeniu częściowym są przyciągane do ujemnych i aromatycznych centrów sąsiednich cząsteczek anthract. I dlatego atrakcje te wywierają efekt kierunkowy, który kieruje cząsteczkami antracena w przestrzeni.
Może ci służyć: stała prędkościZatem antraceen jest uporządkowany w taki sposób, że przyjmuje długą strukturę; I dlatego może krystalizować w systemie monoklinicznym.
Przypuszczalnie kryształy te wykazują żółtawe zabarwienie produktu utleniania do Antraquinona; który pochodzi z antracenu, którego stałe jest żółte.
Nieruchomości
Nazwy chemiczne
-Antracen
-Paraneftalen
-Antracin
-Zielony olej
Formuła molekularna
C14H10 lub (c6H4CH)2.
Waga molekularna
178 234 g/mol.
Opis fizyczny
Biały lub jasnożółty stał. Kryształy monokliniczne produkt rekrystalizacji w alkoholu.
Kolor
Kiedy jest czysty, antraceen jest bezbarwny. Z żółtymi jasnożółtymi kryształami daje fluorescencję niebieskiego koloru. Możesz także przedstawić pewne żółtawe tony.
Zapach
Miękkie aromatyczne.
Punkt wrzenia
341,3 ºC.
Temperatura topnienia
216 ° C.
punkt zapłonu
250 ° F (121 ° C), zamknięta kubek.
Rozpuszczalność wody
Praktycznie nierozpuszczalne w wodzie.
0.022 mg/l wody w 0 ° C
0044 mg/l wody w 25ºC.
Rozpuszczalność etanolu
0,76 g/kg w 16ºC
3,28 g/kg w 25 ° C. Zwróć uwagę, w jaki sposób rozpuszczalny w etanolu niż w wodzie w tej samej temperaturze.
Rozpuszczalność w Hexano
3,7 g/kg.
Rozpuszczalność w benzene
16,3 g/l. Jego największa rozpuszczalność w Benzene pokazuje jego wysokie powinowactwo, ponieważ obie substancje są aromatyczne i cykliczne.
Rozpuszczalność disiarczkowa węglowego
32,25 g/l.
Gęstość
1,24 g/cm3 w 68 ° F (1,25 g/cm3 w 23ºC).
Gęstość pary
6,15 (z powietrzem uznanym za odniesienie równe 1).
Ciśnienie pary
1 mmhg w 293 ° F (Sublima). 6,56 x 10-6 MMHG w 25 ° C.
Stabilność
Jest stabilny, jeśli jest przechowywany w zalecanych warunkach. Jest himinescencyjny i tryboelektryczny; Oznacza to, że emituje światło i elektryczność, gdy się pociera. Antraceń ciemnieje po wystawieniu na światło słoneczne.
Samokierunek
1.004 ºF (540 ° C).
Rozkład
Produkowane są niebezpieczne związki przez spalanie (tlenki węglowe). Rozkłada się po ogrzewaniu pod wpływem silnych utleniaczy, wytwarzając akr i toksyczny dym.
Może ci służyć: nitrobenzen (C6H5N2): Struktura, właściwości, zastosowania, ryzykoCiepło spalania
40110 kJ/kg.
Pojemność kaloryczna
210,5 J/mol · k.
Maksymalna długość fali absorpcji (światło widzialne i ultrafiolet)
Maksymalnie λ 345,6 nm i 363,2 nm.
Breja
-0,602 CPOise (240 ° C)
-0,498 CPOise (270 ° C)
-0,429 CPOise (300 ° C)
Jak widać, jego lepkość maleje wraz ze wzrostem temperatury.
Nomenklatura
Antracen jest jednolitą wielopierścieniową cząsteczką i zgodnie z nomenklaturą ustaloną dla tego typu systemu, jego prawdziwa nazwa powinna być tricenta. Prefiks TRI jest spowodowany faktem, że istnieją trzy pierścienie beancenic. Jednak trywialna nazwa antracene rozszerzyła się i zakorzeniła w kulturze popularnej i naukowej.
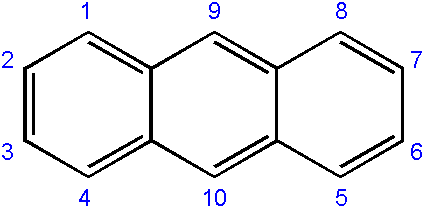
Nomenklatura związków pochodzących z niego jest zwykle nieco złożona i zależy od węgla, w którym następuje wymiana. Poniżej pokazuje odpowiednią numerowanie węgli do władzy:
 Numerowanie węgli w antraceenie. Źródło: Edgar181 [domena publiczna]
Numerowanie węgli w antraceenie. Źródło: Edgar181 [domena publiczna] Numerowanie jest spowodowane priorytetem w reaktywności lub podatności wspomnianych węgli.
Węgi końców (1-4 i 8-5) są najbardziej reaktywne, podczas gdy w środku (9-10) reagują przez inne warunki; Na przykład oksydacyjny, tworząc antraquinon (9, 10-diokontracene).
Toksyczność
W kontakcie ze skórą może powodować podrażnienie, swędzenie i spalanie, które pogarszają się światłem słonecznym. Antracen to fotouczulacz, który wzmacnia uszkodzenia skóry spowodowane promieniowaniem UV. Może powodować ostre zapalenie skóry, teangiektazja i alergia.
W kontakcie z oczami może powodować podrażnienie i oparzenie. Oddychanie antracenu może podrażniać nos, gardło i płuca, powodując kaszel i świszczący oddech.
Spożycie antracenu było powiązane u ludzi z bólem głowy, nudności, utratą apetytu, zapaleniem przewodu pokarmowego, powolnymi reakcjami i osłabieniem.
Pojawiły się sugestie dotyczące raka antracenu. Jednak domniemanie to nie zostało potwierdzone, w tym niektóre pochodne antracenowe zastosowano w leczeniu niektórych rodzajów raka.
Aplikacje
Techniczny
-Antracen jest organicznym półprzewodnikiem, stosowanym jako szpinalista w fotonach o wysokiej energii, elektronach i cząstkach alfa.
-Jest również stosowany do powłoki z tworzyw sztucznych, takich jak polivinilluen. To w celu wytworzenia plastikowych wrzeciołów o charakterystyce podobnej do wody, aby użyć go w radioterapii.
Może ci służyć: piperydyna: struktura, synteza, pochodne, reakcje-Antraceń jest powszechnie stosowany jako ploter promieniowania UV, nakładany w powłoki na płytkach drukowanych. Pozwala to sprawdzić podszewkę za pomocą światła ultrafioletowego.
Samodzielna cząsteczka
W 2005 r. Chemicy z University of California, Riverside, zsyntetyzowali pierwszą standardową cząsteczkę: 9.10-ditioantraton. Jest to wypychane w linii prostej, gdy jest podgrzewana na płaskiej miedzi i może poruszać się tak, jakby miał dwie stopy.
Naukowcy uważali, że cząsteczka była potencjalnie użyteczna w obliczeniach molekularnych.
Piezocromatyczność
Niektóre pochodne antracenu mają właściwości piezochromatyczne, to znaczy mają zdolność zmiany koloru w zależności od zastosowanego ciśnienia. Dlatego mogą być stosowane jako detektory ciśnienia.
Antraceń jest również używany do opracowania ekranów dymowych, które można wycofać.
Ekologiczny
Polityczne węglowodory aromatyczne (PAH) to zanieczyszczenia środowiska, głównie z wody, dlatego podejmowane są wysiłki w celu zmniejszenia toksycznej obecności tych związków.
Antracen jest materiałem (PAH) i jest stosowany jako model, do zbadania zastosowania metody pirolizy wody w degradacji związków PAH.
Piroliza wody jest stosowana w przemysłowym uzdatnianiu wody. Jego działanie na antracenę spowodowało tworzenie się związków utleniania: antrron.
Produkty te są mniej stabilne niż antraceen, a zatem są mniej trwałe w środowisku, mogą być łatwiejsze niż związki PAH.
Inni
-Antraceen utlenia się w celu pochodzenia antruquinonu, stosowanego w syntezie barwników i barwników
-Antraceń jest używany w ochronie drewna. Jest również stosowany jako owadobójca, udar, herbicyd i ratyk.
-Antybiotyk antracykliny zastosowano w chemioterapii, ponieważ hamuje syntezę DNA i RNA. Cząsteczka antracykliny jest przeplatana między zasadami DNA/RNA, hamując replikację szybko rosnących komórek rakowych.
Bibliografia
- Antracen. Źródło: w:.Wikipedia.org
- Antracen. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov

