Historia antymonów, struktura, właściwości, zastosowania i ryzyko

- 3842
- 314
- Matylda Duda
On antymon Jest to lśniący, srebrny metaloid i z pewnym niebieskim odcieniem. Jego stałe charakteryzuje się również bardzo kruchy i płaskonabłonkową teksturą. Należy do grupy 15 stolika okresowego, na czele z azotem. Po Bismuth (i Moskwium) jest to najcięższy element grupy.
Jest reprezentowany przez symbol chemiczny SB. W naturze występuje głównie w minerałach stabitu2S3 i odpowiednio NISBS. Jego wysoka tendencja do tworzenia siarczków zamiast tlenków jest dlatego, że jest chemicznie miękki.
 Krystaliczny antymon. Źródło: Najlepsze tłuszczy science science fatcs [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Krystaliczny antymon. Źródło: Najlepsze tłuszczy science science fatcs [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Z drugiej strony antymon jest również fizycznie miękki, co stanowi twardość 3 w skali MOHS. Jest stabilny w temperaturze pokojowej i nie reaguje z tlenem powietrza. Ale ogrzewany w obecności tlenu, tworzy trutlenek antymonu, SB2ALBO3.
Jest również odporny na działanie słabych kwasów; Ale gorący jest atakowany przez kwasy azotowe i solne.
Antymon ma wiele zastosowań, w tym stosowane w stopach z ołów i cyny, w produkcji akumulatorów do pojazdów, materiałów o niskim tarciu itp.
Ten metaloid ma rzadki, aby zwiększyć objętość po zestaleniu, umożliwiając jego stopom całkowicie zajęcie przestrzeni używanej do kształtowania instrumentu, który jest pożądany do produkcji.
[TOC]
Historia twojego odkrycia
pne
Istnieją dowody, że od 3100 do.C, Sulfid antymonu zastosowano jako kosmetykę w Egipcie. W Mezopotamii, obecnych Iraku, pozostałości wazonu i kolejny artefakt stwierdzono, że rzekomo data między 3000 a 2200 lat.C, w którym był używany w opracowaniu antymonu.
Wprowadzenie tego terminu
Roman Erúdito Plinio El Viejo (23-79 d.c) opisał zastosowanie antymonu, które nazwał Estibio, w opracowaniu siedmiu leków w swoim traktacie z historii naturalnej. Alchemik Abu Mussa Jahir Ibn Hayyan (721-815) przypisuje się wprowadzeniu terminu antymon na mianowanie elementu.
Użył następującej etymologii: „anty” jako synonim zaprzeczenia i „mono” tylko dla. Potem chciał podkreślić, że antymon nie był sam w naturze. Wiadomo już, że jest częścią minerałów siarki, które podobnie jak inne elementy.
Uzyskanie
Uważa się, że greckie naturalne Dhassorides otrzymują czystą antymon, ogrzewając siarczk antymonu w strumieniu powietrza. Włoski metalurgiczny Vannocio Biringucio, w Księdze Pirotechniki (1540), opisuje metodę odizolowania antymonii.
Niemiecki chemik Andreas Libavius (1615), poprzez zastosowanie odlewanej mieszaniny żelaza, siarczku antymonu, soli i potasu, osiągnął produkcję krystalicznej antymonii.
Pierwszy szczegółowy raport na temat antymonii został złożony w 1707 r. Przez francuskiego chemika Nicolasa Lemery (1645-1715), w jego książce leczonej na antymonie.
Może ci służyć: chlorek miedzi (I) (CUCL): Struktura, właściwości, zastosowaniaStruktura antymonu
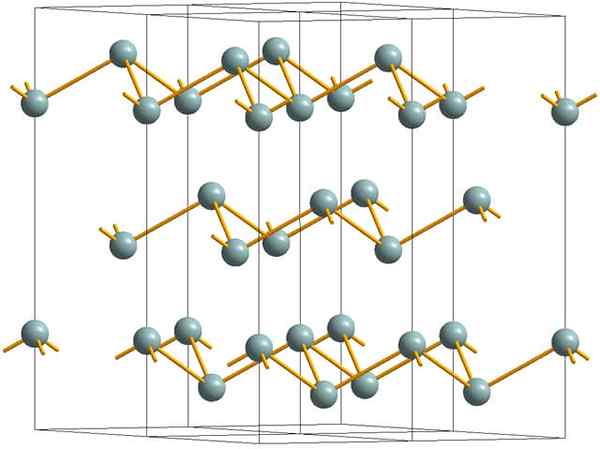 Pomarszczone warstwy tworzące krystaliczną strukturę metalicznego lub srebrnego antymonu. Źródło: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Pomarszczone warstwy tworzące krystaliczną strukturę metalicznego lub srebrnego antymonu. Źródło: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Górny obraz pokazuje strukturę pomarszczonych warstw przyjętych przez atomy arsenu. Jednak szarawe antymon, lepiej znany jako metalowy antymon, również przyjmuje tę strukturę. Mówi się, że jest „pomarszczone”, ponieważ są atomy SB, które rosną i spadają z płaszczyzny złożonej z warstwy.
Warstwy te, chociaż są odpowiedzialne za fotony, które wchodzą z nimi, aby zabłysnąć srebrnych blasków, tworząc antymon jako metal, prawda jest taka, że siły, które je łączą, są słabe; Stąd do pozornych fragmentów metali SB można łatwo pokazać i są kruche lub trampki.
Ponadto atomy SB w pomarszczonych warstwach nie wystarczą, aby zgrupować swoje orbitale atomowe, a tym samym tworzyć pasmo umożliwiające przewodzenie elektryczne.
Widząc indywidualnie szarawą kulę, widać, że ma trzy linki SB-SB. Z wyższej płaszczyzny SB można było zobaczyć w środku trójkąta, z trzema SB znajdującymi się na wierzchołkach. Jednak trójkąt nie jest płaski i ma dwa poziomy lub podłogi.
Boczne reprodukcja takich trójkątów i ich linków ustanawia pomarszczone warstwy, które są wyrównane do tworzenia kryształów romboebicznych.
Alotropia
Nowo opisana struktura odpowiada szarawemu antymonowi, najbardziej stabilnemu z czterech alotropów. Pozostałe trzy alotropy (czarne, żółte i wybuchowe) są metastabilne; to znaczy mogą istnieć w bardzo rygorystycznych warunkach.
Nie ma zbyt wielu informacji dotyczących jego struktur. Wiadomo jednak, że czarny antymon jest amorficzny, tak że jego struktura jest nieuporządkowana i skomplikowana.
Żółty antymon jest stabilny poniżej -90ºC, zachowuje się jako element niemetaliczny i można go przypuszczać, że składa się z małych aglomeratów SB4 (podobny do fosforu); Po podgrzaniu przekształca się w czarny alotrop.
W odniesieniu do wybuchowego antymonu składa się z galaretowatego zbiornika utworzonego na katodzie podczas elektrolizy wodnego roztworu halogenku antymonu.
Do najmniejszych mocnych śmieci.
Nieruchomości
Masa atomowa
121,76 g/mol.
Liczba atomowa
51.
Elektroniczna Konfiguracja
[Kr] 4d105s25 p3.
Stany utleniania
-3, -2, -1, +1, +2, +3, +4, +5.
Opis fizyczny
Lśniące srebro, krucha, płaskonabłonkowa, z niebieskim odcieniem. Może również pojawić się jako czarny kurz.
Temperatura topnienia
630,63 ºC.
Punkt wrzenia
1.635 ° C.
Gęstość
-6 697 g/cm3 w temperaturze pokojowej.
-6,53 g/cm3 W stanie ciekłym temperatura równa lub więcej niż temperatura topnienia.
Fusion Heat
19,79 kJ/mol.
Ciepło parowe
193,43 kJ/mol.
Może ci służyć: siarczek miedzi: struktura, właściwości, zastosowaniaPojemność kaloryczna trzonowa
25,23 J/mol.K
Elektronialiczność
2.05 (Skala Pauling).
Radio atomowe
140 PM.
Twardość
Jest to miękki element o twardości 3 w skali Mohsa i może być porysowany przez szkło.
Stabilność
Jest stabilny w temperaturze pokojowej, nie doświadczając utleniania. Jest również odporny na atak kwasu.
Izotopy
Ma dwa stabilne izotopy: 121Sb i 123Sb. Ponadto istnieje 35 radioaktywnych izotopów. Radioaktywny izotop 125SB to ten z największą półfinią: 2,75 lat. Zasadniczo izotopy radioaktywne emitują promieniowanie β+ i β-.
Przewodność elektryczna i termiczna
Antymon jest złym przewodnikiem ciepła i prądu.
Reaktywność chemiczna
Nie może wypierać wodoru z rozcieńczonych kwasów. Kompleks jonowy z kwasami organicznymi i nieorganicznymi. Metaliczny antymon nie reaguje z powietrzem, ale szybko przekształca się w tlenek w mokre powietrze.
Halogeny i siarczki łatwo utleniają antymon, jeśli proces występuje w wysokich temperaturach.
Aplikacje
Stopy
Antymon jest stosowany w stopie z ołów do opracowania płyt do akumulatorów samochodowych, poprawiając odporność płyt, a także charakterystykę obciążeń.
Stop ołowiu i cyny został wykorzystany do poprawy cech spoin, a także charakterystycznych pocisków i nabojów. Jest również stosowany w stopach do elektrycznej powłoki kablowej.
Antymon jest stosowany w stopach przeciwdziałania, w przygotowaniu skórki i stwardnienia o niskiej zawartości cyny w produkcji narządów i innych instrumentów muzycznych.
Przedstawia charakterystykę, dzieloną z wodą, rosnącej objętości po skondensowaniu; Tak więc antymon obecny w stopach ołowiu i cyny wypełnia wszystkie przestrzenie form, poprawiając definicję struktur wykonanych z tych stopów.
Ognioodporny
TRIOTOLENEK ANTYMONY jest stosowany do opracowania związków ignorowanych, zawsze w połączeniu z fluenianymi opóźnionymi przeciwpożarami, bromurosem i chlorkiem.
Opóźniacze przeciwpożarowe mogą reagować z tlenem i radykalnymi atomami OH, co hamuje ogień. Te ignorowane są używane w ubraniach dla dzieci, zabawek, samolotów i fotelików samochodowych.
Są one również dodawane do żywic poliestrowych, a w kompozach z włókna szklanego dla używanych przedmiotów, takich jak osłona lekkich samolotów.
Związki antymonów stosowane jako opóźniacze przeciwpożarowe obejmują: przeciwmiot oksychlorku, sBOCL; Pentlenek antymonu, SBO5; Trichlorek antymonu, SBCL3; i tritlenek antymonu, SBO3.
Pole elektroniczne
Jest stosowany w produkcji półprzewodników, diod, detektorów średniej podczerwieni oraz w opracowaniu tranzytora. Antymony o wysokiej czystości, stosowane w technologii półprzewodników, uzyskuje się przez zmniejszenie związków antymonicznych z wodorem.
Może ci służyć: czynniki wpływające na rozpuszczalnośćMedycyna i weterynaryjne
Związki antymonów stosowano w medycynie od czasów starożytnych, takich jak Eméticas i Antiprotozoa. Tartato potasu potasu (estetyczna kamienista) stosowano przez długi czas jako niezgoda antysemosomalna; Stosowane również jako wykrztuśne, śliczne i emético.
Sole antymonu zastosowano również w kondycjonowaniu skóry zwierząt przeżuwaczych; takie jak aninomalina, lit i tiomalan antymonu.
Antymony megluminy to lek stosowany w leczeniu leiszmaniozy w zewnętrznych reflektorach zwierząt domowych. Chociaż korzyści terapeutyczne były rzadkie.
Pigmenty i obrazy
Związki antymonu są stosowane w opracowaniu farb i maltora w emalii. Są one również stosowane w Bermellón, żółto i pomarańczowych pigmentów, które są produktami powolnego utleniania siarczków antymonicznych.
Niektóre z jego soli ekologicznych (tartratos) są używane w przemyśle tekstylnym, aby pomóc w związku niektórych barwników.
Siarczek antymonu zastosowano w starożytnym Egipcie jako kosmetyczne w ciemnieniu oczu.
Inne zastosowania
Niektóre sole antymonów są stosowane jako środki powlekania w celu wyeliminowania mikroskopijnych pęcherzyków, które powstają na ekranach telewizyjnych. Jony antymonu oddziałują z tlenem, eliminując ich tendencję do tworzenia bąbelków.
Siarczek antymonu (III) jest używany w głowach niektórych meczów bezpieczeństwa. Siarko antymonu stosuje się również do stabilizacji współczynnika tarcia materiałów stosowanych w podkładkach hamulcowych samochodów.
Izotop 124SB, wraz z berylum, jest używany jako źródło neutronów, ze średnią energii wynoszącą 24 keV. Ponadto antymon jest wykorzystywany jako katalizator w produkcji tworzyw sztucznych.
Ryzyko
Jest to krucha element, dzięki czemu podczas manipulacji może wystąpić proszek zanieczyszczenia środowiska. U pracowników narażenia na kurz przeciwmiotium.
Pneumokonioza została opisana, czasem w połączeniu z obturacyjnymi zmianami płuc, po przedłużonych wystawach.
Antymony tritlenek może powodować uszkodzenie funkcjonowania serca, które mogą być śmiertelne.
U osób narażonych na ten element zaobserwowano obecność zakażeń skórnych, o charakterze przejściowym.
Ciągłe spożycie niskiej dawki tego metalu może powodować wymioty biegunki i wrzody żołądkowe. Również maksymalne tolerowane stężenie w powietrzu wynosi 0,5 mg/m3.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Manny. (11 marca 2009 r.). Żółty antymon i wybuchowy antymon. Źródło: AntimonyProperties.Blogspot.com
- Prof. Ernst Cohen i J. C. Van den Bosch. (1914). Alotropia antymonu. Procedury Royal Acad. Amsterdam. Tom. XVII.
- Wikipedia. (2019). Antymon. Źródło: w:.Wikipedia.org
- Advameg, inc. (2019). Antymon. Odzyskane z: chemistryrexplaed.com
- Mc'oneal Sabre. (15 września 2018 r.). Chemia: właściwości i zastosowanie SB-animony. Odzyskane z: medium.com
- « Historia biogeografii, jakie przykłady badań i badań
- Przyczyny zanieczyszczenia słuchu, konsekwencje, rozwiązania »

