Bezwodne

- 1168
- 309
- Filip Augustyn
Co to są bezwodne?
Bezwodne Są to związki chemiczne, które pochodzą ze zjednoczenia dwóch cząsteczek przez wyzwolenie wody. Zatem można to postrzegać jako odwodnienie początkowych substancji; Chociaż nie jest to dokładnie prawda.
W chemii organicznej i nieorganicznej są wymieniane, aw obu oddziałach ich zrozumienie różni się w znacznym stopniu. Na przykład w chemii nieorganicznej są uważane za podstawowe i kwasowe tlenki, takie jak bezwodne ich wodorotlenków i kwasów, ponieważ poprzednie reagują z wodą, tworząc drugie.
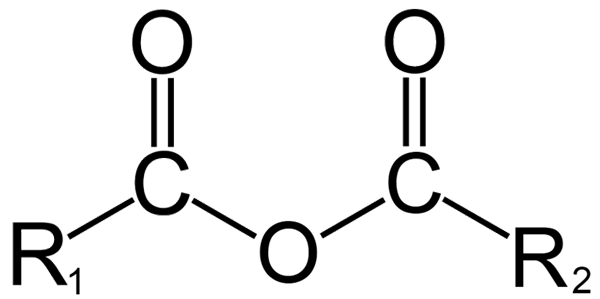 Ogólna struktura bezwodek. Źródło: Dremmetbrownie [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)], z Wikimedia Commons
Ogólna struktura bezwodek. Źródło: Dremmetbrownie [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)], z Wikimedia Commons Tutaj można wygenerować zamieszanie między terminami „bezwodne” i „anhydo”. Zasadniczo bezwodne odnosi się do związku, do którego został odwodniony bez zmian w charakterze chemicznym (nie ma reakcji); Podczas gdy z bezwodnikiem występuje zmiana chemiczna, odzwierciedlona w strukturze molekularnej.
Jeśli porównywane zostaną odpowiednie wodorotlenki i kwasy (lub bezwodne), zaobserwowano, że nastąpiła reakcja. Z drugiej strony niektóre tlenki lub sole mogą być nawodnione, stracić wodę i nadal są tymi samymi związkami; Ale bez wody, anhydros.
Z drugiej strony w chemii organicznej to, co rozumiane jest przez bezwodnik, jest początkową definicją. Na przykład jednym z najbardziej znanych bezwodek są te pochodzące z kwasów karboksylowych (obraz doskonały). Składają się one ze połączenia dwóch grup acylowych (-RCO) przez atom tlenu.
W swojej ogólnej strukturze R jest wskazane1 Dla grupy acylowej i r2 Dla drugiej grupy Acilo. Ponieważ r1 i r2 Są różne, pochodzą z różnych kwasów karboksylowych, a następnie jest to asymetryczny bezwodnik kwasu. Kiedy obaj podstawniki r (czy to aromatyczne) są takie same, w takim przypadku symetrycznego bezwodnika kwasu.
W momencie połączenia dwóch kwasów karboksylowych z utworzeniem bezwodnika, woda może lub nie, a także inne związki. Wszystko będzie zależeć od struktury tych kwasów.
Właściwości bezwodne
Właściwości bezwodników będą zależeć od tego, o których się odnosi. Prawie wszyscy mają wspólnego, że reagują z wodą. Jednak w przypadku podawanych podstawowych bezwodek w nieorganicznych, kilka z nich jest nawet nierozpuszczalnych w wodzie (MGO), więc to stwierdzenie skupia się na bezwodach kwasów karboksylowych kwasów karboksylowych.
Punkty fuzji i wrzenia spadają na strukturę molekularną i interakcje międzycząsteczkowe dla (RCO)2Lub jest to ogólny wzór chemiczny tych związków organicznych.
Jeśli masa cząsteczkowa (RCO)2Lub jest niski, prawdopodobnie jest to bezbarwna ciecz w temperaturze pokojowej i ciśnieniu. Na przykład bezwodnik octowy (lub ehydridge3WSPÓŁ)2Lub jest to płyn i najważniejsze znaczenie przemysłowe, a jego produkcja jest bardzo ogromna.
Reakcja bezwodnika octowego a wodą jest reprezentowana przez następujące równanie chemiczne:
(Ch3WSPÓŁ)2Lub + h2O => 2ch3Cooh
Zauważ, że po dodaniu cząsteczki wody uwolniono dwie cząsteczki kwasu octowego. Odwrotna reakcja nie może jednak wystąpić w przypadku kwasu octowego:
Może ci służyć: równowaga płynów2ch3Cooh => (cho3WSPÓŁ)2Lub + h2Lub (nie dzieje się)
Należy uciekać się do innej syntetycznej trasy. Z drugiej strony kwasy dikarboksylowe mogą to zrobić poprzez ogrzewanie; Ale zostanie to wyjaśnione w następnej sekcji.
Reakcje chemiczne
Hydroliza
Jedną z najprostszych reakcji bezwodnych jest ich hydroliza, która właśnie pokazano w przypadku bezwodnika octowego. Oprócz tego przykładu występuje bezwodnik kwasu siarkowego:
H2S2ALBO7 + H2Lub 2H2południowy zachód4
Tutaj masz bezwodnik kwasu nieorganicznego. Zauważ, że dla h2S2ALBO7 (zwany także kwasem disiulfurowym), reakcja jest odwracalna, więc ogrzewanie h2południowy zachód4 koncentrat powoduje powstawanie jego bezwodnika. Z drugiej strony, jest to rozcieńczone rozwiązanie H2południowy zachód4, Jest tak wydany3, Bezwodnik siarkowy.
Estryfikacja
Bezwodniki kwasowe reagują z alkoholem, z pirydyną na środku, aby zwiększyć ester i kwas karboksylowy. Na przykład rozważana jest reakcja między bezwodnikiem octowym a etanolem:
(Ch3WSPÓŁ)2Lub + ch3Ch2OH => Cho3WSPÓŁ2Ch2Ch3 + Ch3Cooh
Tworząc w ten sposób ester etanowy etylu, ch3WSPÓŁ2Ch2Ch3, i kwas etanowy (kwas octowy).
Praktycznie to, co się dzieje, to wymiana wodoru grupy hydroksylowej przez grupę Aquilus:
R1-Oh => r1-Ocor2
W przypadku (ch3WSPÓŁ)2Lub twoja grupa acilo jest zorkiem3. Dlatego mówi się, że grupa OH przechodzi acylacja. Acylacja i estryfikacja nie są jednak pojęciami wymiennymi; Acylacja może wystąpić bezpośrednio w aromatycznym pierścieniu, znanym jako nazwa acylacji Friedel-Crafts.
Zatem alkohole w obecności bezwodek kwasowych są esteryfikowane przez acylacja.
Z drugiej strony tylko jedna z dwóch grup kwasowych reaguje z alkoholem, a druga pozostaje z wodorem tworzącym kwas karboksylowy; że w przypadku (Cho3WSPÓŁ)2Lub jest to kwas etanowy.
Zmiana
Bezwodniki kwasowe reagują z amoniakiem lub aminami (pierwotne i wtórne), aby zwiększyć amidy. Reakcja jest bardzo podobna do nowo opisanej estryfikacji, ale ROH zastępuje aminę; Na przykład wtórna amina, r2NH.
Ponownie reakcja między (CH3WSPÓŁ)2Lub i dietyloamina, it2NH:
(Ch3WSPÓŁ)2O + 2et2NH => CH3Cd2 + Ch3Gruchać- +NH2Et2
I tworzone są dieetylacetamid, Cho3Cd2, i karboksylowana sól amonowa, Cho3Gruchać- +NH2Et2.
Chociaż równanie może wydawać się nieco trudne do zrozumienia, wystarczy zaobserwować, w jaki sposób grupa -zaprześ3 Wymień H z ET2NH, aby utworzyć Amida:
Et2Nh => et2NCOCH3
Więcej niż pochylenie reakcją jest nadal acylacja. Wszystko jest podsumowane w tym słowie; Tym razem Amina cierpi z powodu acylacji, a nie alkoholu.
Jak wyglądają bezwodne?
Bezwodniki nieorganiczne powstają przez reakcję pierwiastka z tlenem. Tak więc, jeśli element jest metaliczny, powstaje podstawowy tlenek metaliczny; A jeśli nie jest to metalowy, powstaje nie -metalowy tlenek lub bezwodnik kwasowy.
Może ci służyć: równanie Clausius-clapeyron: po co to jest przykłady, ćwiczeniaW przypadku bezwodek organicznych reakcja jest kolejna. Dwa kwasy karboksylowe nie mogą połączyć bezpośrednio w celu uwolnienia wody i utworzenia kwasu bezwodnika; Udział związku, który nie został jeszcze wspomniany: chlorek acylu, RCOCL jest konieczny.
Kwas karboksylowy reaguje z chlorkiem kwasowym, wytwarzając odpowiedni bezwodnik i chlorek wodoru:
R1Cocl + R2Cooh => (r1Co) lub (cor2) + HCl
Ch3COCL + CH3Cooh => (cho3WSPÓŁ)2O + HCl
Ch3 pochodzi z grupy acetylowej, Cho3Ko-, a drugi jest już obecny w kwasie octowym. Wybór określonego chlorku kwasu, a także kwasu karboksylowego, może powodować syntezę symetrycznego lub asymetrycznego bezwodnika kwasu.
Cykliczne bezwodne
W przeciwieństwie do innych kwasów karboksylowych, które wymagają chlorku kwasu, kwasy dikarboksylowe mogą skondensować. Aby to zrobić, konieczne jest ich podgrzewanie, aby promować wydanie H2ALBO. Na przykład tworzenie bezwodnika ftalicznego pokazano z kwasu fotowolodowego.
 FTALICZNE FORMACJA Bezwodników. Źródło: Jü [domena publiczna], z Wikimedia Commons
FTALICZNE FORMACJA Bezwodników. Źródło: Jü [domena publiczna], z Wikimedia Commons Zwróć uwagę, w jaki sposób ukończony jest pierścień pięciokąta, a tlen, który łączy obie grupy C = O, jest jego częścią; To jest cykliczny bezwodnik. Można również zauważyć, że bezwodnik ftaliczny jest bezwodnikiem symetryczny, ponieważ tyle R1 jak r2 Są identyczne: aromatyczny pierścień.
Nie wszystkie kwasy dikarboksylowe są w stanie utworzyć bezwodnik, ponieważ gdy ich grupy COOH są bardzo oddzielone, są zmuszone do ukończenia coraz większych pierścieni. Największy pierścień, który można uformować, jest sześciokąta, większa niż reakcja nie ma miejsca.
Nomenklatura
Jak nazywane są bezwodne? Odkładając na bok nieorganiczne, istotne dla problemów z tlenkiem, nazwy analityków organicznych do tej pory wyjaśniają to tożsamość r1 i r2; to znaczy jego grupy acylowe.
Jeśli dwa r są takie same, wystarczy zastąpić słowo „kwas” na „anhydid” w odpowiednią nazwę kwasu karboksylowego. A jeśli wręcz przeciwnie, dwa R są różne, są wymienione w kolejności alfabetycznej. Dlatego, aby wiedzieć, jak to nazwać, musisz zobaczyć najpierw, jeśli jest to bezwodnik symetryczny lub asymetryczny.
Ch3WSPÓŁ)2Lub jest symetryczne, ponieważ r1= R2 = Ch3. Pochodzi od kwasu octowego lub etanocznego, więc jego nazwa nazywa się, po poprzednim wyjaśnieniu: bezwodek octowy lub etanowy. To samo dzieje się z wymienionym bezwodnikiem ftalicznym.
Załóżmy, że masz następujący bezwodnik:
Ch3CO (O) COCH2Ch2Ch2Ch2Ch2Ch3
Grupa acetylowa po lewej pochodzi z kwasu octowego i po prawej, z kwasu heptanowego. Aby wymienić ten bezwodnik, musisz wyznaczyć jego grupy R w porządku alfabetycznym. Nazywa się więc: heptanowy bezwodnik octowy.
Aplikacje
Bezwodniki nieorganiczne mają niekończące się zastosowania, z syntezy i sformułowania materiałów, ceramiki, katalizatorów, cementów, elektrod, nawozów itp., Aż jako powłoka skorupy Ziemi z tysiącami żelaza i aluminiowych minerałów oraz dwutlenek węgla wydychany żywymi organizmami.
Może ci służyć: dekantacja: koncepcja, przykłady i typyReprezentują źródło początkowe, punkt, w którym wiele związków stosuje się w syntezie nieorganicznej. Jednym z najważniejszych bezwodek jest Carbonic, CO2. Jest to wraz z wodą, niezbędne do fotosyntezy. I na poziomie przemysłowym SO3 Jest to niezbędne, ponieważ pozwany kwas siarkowy jest z niego uzyskiwany.
Być może bezwodnik z większymi zastosowaniami i do posiadania (o ile istnieje życie) jest taki z kwasu fosforowego: tryposforan adenozyny, lepiej znany jako ATP, obecny w DNA i „walucie energetycznej” metabolizmu.
Organiczne bezwodne
Bezwodniki kwasowe reagują przez acylowanie, albo na alkohol, tworząc ester, aminę, powodując powstanie amidy lub aromatyczny pierścień.
Istnieją miliony z tych związków i setki tysięcy opcji kwasu karboksylowego w celu przygotowania bezwodnika; Dlatego syntetyczne możliwości drastycznie rosną.
Zatem jednym z głównych zastosowań jest włączenie grupy kwasowej do związku, zastępując jeden z atomów lub grup jej struktury.
Każdy dwutlenek ma osobno własne zastosowania, ale ogólnie rzecz biorąc, wszystkie reagują w podobny sposób. Z tego powodu tego rodzaju związki są używane do modyfikacji struktur polimerowych, tworząc nowe polimery; to znaczy kopolimery, żywice, powłoki itp.
Na przykład bezwodnik octowy służy do acetylowania wszystkich grup OH celulozy (niższy obraz). Dzięki temu każdy H OH jest zastępowany przez grupę acetylową, Coch3.
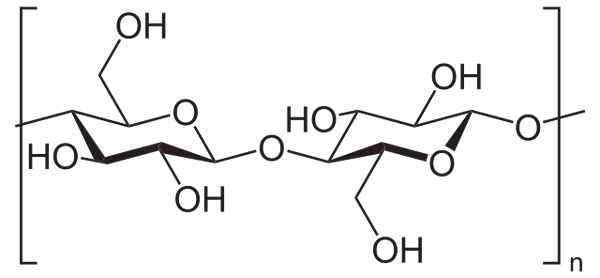 Celuloza. Źródło: Neuropoger [domena publiczna], z Wikimedia Commons
Celuloza. Źródło: Neuropoger [domena publiczna], z Wikimedia Commons W ten sposób uzyskuje się polimer octanu celulozy. Tę samą reakcję można naszkicować innymi strukturami polimerowymi z grupami NH2, Również podatne na acylacja.
Te reakcje acylacji są również przydatne do syntezy leków, takich jak aspiryna (kwas acetylsalicylowy).
Przykłady
Wykazują się, że kończą inne przykłady bezwodności organicznej. Chociaż nie będą o nich wspominać, atomy tlenu można zastąpić siarką, podając bezwodki siarkowe, a nawet fosfor.
-C6H5Co (o) gotować6H5: Bezwodnik benzoiczny. Grupa c6H5 reprezentuje pierścień benzenowy. Jego hydroliza wytwarza dwa kwasy benzoesowe.
-HCO (O) COH: formalny bezwst. Jego hydroliza wytwarza dwa kwasy mrówkowe.
- C6H5CO (O) COCH2Ch3: Propanowy bezwodnik benzoiczny. Jego hydroliza wytwarza kwasy benzoiczne i propaniczne.
-C6HjedenaścieCo (o) gotować6Hjedenaście: Cykloheksorokroboksylikaniczny anhyd. W przeciwieństwie do pierścieni aromatycznych, są one nasycone, bez podwójnych linków.
-Ch3Ch2Ch2CO (O) COCH2Ch3: Propanowy bezwodnik butaniczny.
Bezwodnik bursztynowy
 Bezwodnik bursztynowy. Źródło: Ninjatacoshell [domena publiczna], z Wikimedia Commons
Bezwodnik bursztynowy. Źródło: Ninjatacoshell [domena publiczna], z Wikimedia Commons Tutaj masz kolejny cykliczny, pochodzący z kwasu bursztynowego, kwasu dikarboksylowego. Uwaga jak trzy atomy tlenu zdradzają chemiczny charakter tego rodzaju związku.
Maleico bezwodnika jest bardzo podobny do analizy sukcesyna, z różnicą, że istnieje podwójne wiązanie między węglemi, które tworzą podstawę Pentagonu.
Bezwodnik glutarianina
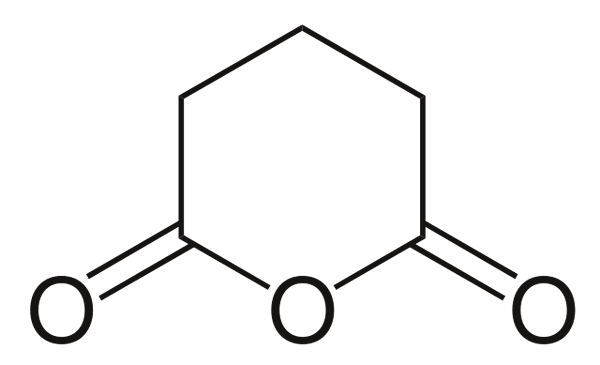 Bezwodnik glutarianina. Źródło: Choij [domena publiczna], z Wikimedia Commons
Bezwodnik glutarianina. Źródło: Choij [domena publiczna], z Wikimedia Commons I wreszcie pokazano bezwodnik kwasu glutarowego. To strukturalnie rozróżnia wszystkie inne, składając się z sześciokątnego pierścienia. Ponownie trzy atomy tlenu wyróżniają się w strukturze.
Inne bardziej złożone bezwodne mogą być zawsze udowodnione przez trzy atomy tlenu bardzo blisko siebie.
Bibliografia
- Bezwodnik. Enclyclopaedia Britannica. Odzyskane z: Britannica.com
- Definicja bezwodnika kwasu w chemii. Odzyskane z: Thoughtco.com

