Prawo o ochronie materii
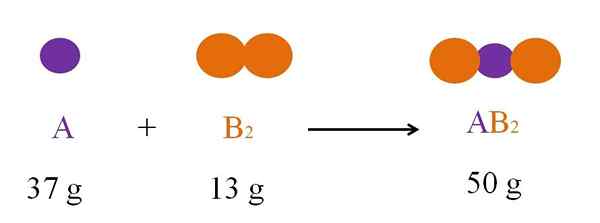
- 4385
- 1175
- Herbert Wróblewski
Jakie jest prawo ochrony materii?
Prawo dotyczące zachowania materii lub masy Jest to taki, który stwierdza, że w każdej reakcji chemicznej materia nie jest tworzona ani niszczona. Prawo to opiera się na fakcie, że atomy są niepodzielnymi cząstkami w tego typu reakcjach; Podczas gdy w reakcjach jądrowych atomy są rozdrobnione, dlatego nie są uważane za reakcje chemiczne.
Jeśli atomy nie zostaną zniszczone, to gdy reaguje element lub związek, liczba atomów musi być stała przed i po reakcji; co przekłada się na stałą masę między zaangażowanymi odczynnikami i produktami.
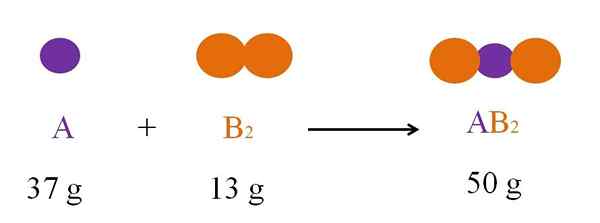 Reakcja chemiczna między A i B2. Źródło: Gabriel Bolívar
Reakcja chemiczna między A i B2. Źródło: Gabriel Bolívar Jest to zawsze, jeśli nie ma wycieku, który powoduje straty materii; Ale jeśli reaktor jest szczelnie zamknięty, nie znika on żadnego atomu, a zatem obciążona masa musi być równa masy po reakcji.
Z drugiej strony, jeśli produkt jest solidny, jego masa będzie równa sumie odczynników zaangażowanych w ich powstawanie. Podobnie występuje w przypadku produktów cieczy lub gazowych, ale jest bardziej prawdopodobne, że popełnia błędy podczas pomiaru powstałych mas.
Prawo to narodziło się z eksperymentów z poprzednich stuleci, wzmacniając się w wkładu kilku znanych chemikaliów, takich jak Antoine Lavoisier.
Rozważ reakcję między A i B2 Aby uformować AB2 (obraz górny). Zgodnie z prawem ochrony materii, masa AB2 Musi być równe sumie mas a i b2, odpowiednio. Tak więc, jeśli 37 g react z 13 g B2, Produkt AB2 Musisz ważyć 50 g.
Dlatego w równaniu chemicznym masa odczynników (A i B2) musi być zawsze równe masie produktów (AB2).
Przykładem bardzo podobnym do nowo opisanego jest to tworzenie tlenków metali, takich jak mocz lub rdza. Rdza jest cięższa niż żelazo (nawet jeśli się wydaje), ponieważ metal reagował na masę tlenu w celu wytworzenia tlenku.
Jak to prawo stosuje się w równaniu chemicznym?
Prawo do ochrony masowej ma transcendentalne znaczenie w stechiometrii, przy czym te ostatnie definiuje się jako obliczenie ilościowych związków między odczynnikami a produktami obecnymi w reakcji chemicznej.
Zasady stechiometrii zostały podane w 1792 r. Jeremiah Benjamín Richter (1762–1807), który zdefiniował to jako naukę, która mierzy proporcje ilościowe lub relacje masowe elementów chemicznych, które są zaangażowane w reakcję reakcji.
W reakcji chemicznej istnieje modyfikacja zaangażowanych w nią substancji. Zauważono, że odczynniki lub reagenty są spożywane w celu powodowania produktów.
Może ci służyć: metale żelaznePodczas reakcji chemicznej występują wiązania między atomami, a także tworzenie nowych ogniw; Ale liczba atomów zaangażowanych w reakcję pozostaje niezmieniona. To jest znane jako prawo ochrony materii.
Podstawowe zasady
To prawo implikuje dwie podstawowe zasady:
-Całkowita liczba atomów każdego typu jest taka sama w odczynnikach (przed reakcją) i w produktach (po reakcji).
-Całkowita suma ładunków elektrycznych przed i po reakcji pozostaje stała.
Jest tak, ponieważ liczba cząstek subatomowych pozostaje stała. Cząstki te są neutronami bez ładunku elektrycznego, protonów obciążenia dodatniego (+) i elektronów ujemnych (-) (-). Więc ładunek elektryczny nie zmienia się podczas reakcji.
Równanie chemiczne
Powiedziawszy powyżej, reprezentując reakcję chemiczną poprzez równanie (takie jak główny obraz), należy przestrzegać podstawowych zasad. Równanie chemiczne wykorzystuje symbole lub reprezentacje różnych pierwiastków lub atomów oraz sposób, w jaki są one pogrupowane w cząsteczki przed lub po reakcji.
Poniższe równanie zostanie ponownie użyte jako przykład:
A+B2 => AB2
Klodka indnalna jest liczbą umieszczoną we właściwej części elementów (b2 i ab2) Na dole, wskazując liczbę atomów elementu obecnego w cząsteczce. Tej liczby nie można zmienić bez produkcji nowej cząsteczki, innej od oryginału.
Współczynnik stechiometryczny (1, w przypadku A i reszty gatunku) jest liczbą umieszczoną po lewej stronie atomów lub cząsteczek, co wskazuje na ich liczbę zaangażowaną w reakcję.
W równaniu chemicznym, jeśli reakcja jest nieodwracalna, umieszczana jest pojedyncza strzałka, co wskazuje na znaczenie reakcji. Jeśli reakcja jest odwracalna, w przeciwnym kierunku występują dwie strzałki. Po lewej stronie strzał znajdują się odczynniki lub reagenty (A i B2), gdy po prawej są produkty (AB2).
Wahadłowy
Równowaga równanie chemiczne to procedura, która pozwala na liczbę atomów elementów chemicznych obecnych w odczynnikach z elementami produktów.
Innymi słowy, liczba atomów każdego elementu musi być taka sama po stronie odczynników (przed strzałką) i po stronie produktów reakcyjnych (po strzałce).
Mówi się, że gdy reakcja jest zrównoważona, szanowana jest masa działania.
Dlatego konieczne jest zrównoważenie liczby atomów i ładunków elektrycznych po obu stronach strzałki w równaniu chemicznym. Podobnie suma mas odczynników musi być równa suma mas produktów.
Może ci służyć: prawo gazów idealnych: formuła i jednostki, zastosowania, przykładyW przypadku reprezentowanego równania jest on już zrównoważony (ta sama liczba A i B po obu stronach strzałki).
Eksperymenty, które pokazują prawo
Spalanie metalu
Lavoiser, obserwując spalanie metali, takich jak ołów i cyna w zamkniętych pojemnikach o ograniczonym dochodzie powietrza, naprawił, że metale były pokryte kalcynowanymi; A ponadto, że waga metalu w pewnym momencie ogrzewania była równa początkowej.
Gdy metal spopiał przyrost masy ciała, Lavoiser pomyślał, że zaobserwowana nadmiar masy można wytłumaczyć pewną masą czegoś, co jest wydobywane z powietrza podczas spalania. Z tego powodu ciasto pozostało stałe.
Ten wniosek, który można rozważyć z nieco solidnymi podstawami naukowymi, nie jest taka, biorąc pod uwagę wiedzę, że Lavoiser miał na temat istnienia tlenu na chwilę, że wypowiedział swoje prawo (1785).
Uwolnienie tlenu
Tlen został odkryty przez Carl Willhelm Scheele w 1772 roku. Następnie Joseph Priesley odkrył to niezależnie i opublikował wyniki swoich badań, trzy lata przed Scheele opublikował swoje wyniki na temat tego samego gazu.
Priesley rozgrzał tlenek rtęci i podniósł gaz, który spowodował wzrost błyskotliwości płomienia. Ponadto, wprowadzając myszy do pojemnika z gazem, stały się bardziej aktywne. Priesley nazwał ten deflowerowany gaz.
Priesley przekazał swoje obserwacje Antoine Lavoiser (1775), który powtórzył swoje eksperymenty, pokazując, że gaz był w powietrzu i w wodzie. Lavoiser rozpoznał gaz za nowy element, nadając mu nazwę tlenu.
Kiedy Lavoisier użył jako argument do stwierdzenia swojego prawa, że nadmiar masy obserwowanej podczas spalania metali był spowodowany czymś, co zostało wydobyte z powietrza, pomyślał o tlenu, elemencie połączonym z metaliami podczas spalania.
Przykłady (ćwiczenia praktyczne)
Rozkład tlenku rtęci
Jeśli 232,6 tlenku rtęci (HGO) jest ogrzewane, rozkłada się on w rtęci (HG) i tlenu cząsteczkowym (lub2). W oparciu o prawo ochrony masy masy i atomowych: (Hg = 206,6 g/mol) i (o = 16 g/mol), wskazują masę Hg i O2 to powstało.
Hgo => hg +o2
232,6 g 206,6 g 32 g
Obliczenia są bardzo bezpośrednie, ponieważ dokładnie jeden mol HGO się rozkłada.
Spalanie taśmy magnezowej
 Płonąca taśma magnezowa. Źródło: Capt. John Yossarian [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0) lub gfdl (http: // www.gnu antylopa.Org/copyleft/fdl.html)], z Wikimedia Commons
Płonąca taśma magnezowa. Źródło: Capt. John Yossarian [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0) lub gfdl (http: // www.gnu antylopa.Org/copyleft/fdl.html)], z Wikimedia Commons 1,2 g taśmy magnezowej spalono w zamkniętym pojemniku zawierającym 4 g tlenu. Po reakcji było 3,2 g tlenu bez reagowania. Ile powstało tlenku magnezu?
Może ci służyć: zmiany stanu: typy i ich cechy (z przykładami)Pierwszą rzeczą do obliczenia jest masa tlenu, która reagowała. Można to łatwo obliczyć, odejmując:
Masa O2 który zareagował = początkowa masa lub2 - Ostateczna masa O2
(4 - 3,2) g lub2
0,8 g o2
Na podstawie prawa masowej ochrony można obliczyć masę utworzonej MGO.
Masa MGO = mg masa + masa o
1,2 g+0,8 g
2.0 G MGO
Wodorotlenek wapnia
Masa 14 g tlenku wapnia (CaO) reagowała z 3,6 g wody (h2O), który został całkowicie zużyty w reakcji z wytworzeniem 14,8 g wodorotlenku wapnia, CA (OH)2:
Jaka ilość tlenku wapnia reagowała z wytworzeniem wodorotlenku wapnia?
Jaka ilość tlenku wapnia minęła?
Reakcję może być schematyzowana przez następujące równanie:
Cao + h2O => ca (oh)2
Równanie jest zrównoważone. Dlatego jest zgodne z prawem do ochrony masowej.
Masa Cao zaangażowana w reakcję = masa Ca (OH)2 - Masa H2ALBO
14,8 g - 3,6 g
11.2 G Cao
Dlatego CAO, który nie zareagował (pozostały), jest obliczany przez dokonanie odejmowania:
Superant Masa CaO = masa obecna w reakcji - masa, która interweniowała w reakcji.
14 g Cao - 11,2 g Cao
2,8 G Cao
Tlenek miedzi
Ile tlenku miedzi (CUO) powstanie, gdy 11 g miedzi (Cu) z tlenem (lub2)? Ile tlenu jest potrzebne w reakcji?
Pierwszym krokiem jest zrównoważenie równania. Zrównoważone równanie jest następujące:
2CU + o2 => 2CUO
Równanie jest zrównoważone, więc jest zgodne z prawem masowej ochrony.
Masa atomowa Cu wynosi 63,5 g/mol, a masa cząsteczkowa wynosi 79,5 g/mol.
Musisz ustalić, ile COO powstaje z całkowitego utleniania 11 g Cu:
Masa CUO = (11 g Cu) ∙ (1mol Cu/63,5 g Cu) ∙ (2 mol Cuo/2mol Cu) ∙ (79,5 g Cuo/mol CuO)
Masa CUO sformowana = 13,77 g
Dlatego różnica w masach między CUO i Cu daje ilość tlenu zaangażowanego w reakcję:
Masa tlenu = 13,77 g - 11 g
1,77 g o2
Tworzenie chlorku sodu
Masa chloru (CL2) 2,47 g poddano reakcji z wystarczającą ilością sodu (Na) i 3,82 g chlorku sodu (NaCl). Ile zareagował na?
Równanie zrównoważone:
2na + cl2 => 2nacl
Zgodnie z ustawą o ochronie masowej:
Na = masa NaCl - masa CL2
3,82 g - 2,47 g
1,35 g na
Bibliografia
- National Polytechnic Institute. (S.F.). Prawo zachowania masy. Cgfie. Odzyskane z: AEV.Cgfie.Ipn.MX
- Prawo zachowania masy. Odzyskane z: Thoughtco.com

