Charakterystyka alaniny, struktura, funkcje, biosynteza
- 997
- 114
- Estera Wojtkowiak
do dziewczyny (Wing) jest jednym z 22 znanych aminokwasów, które tworzą strukturę białek wszystkich organizmów, od bakterii po mężczyzn. Ponieważ organizm może syntetyzować, jest to klasyfikowane jako nieistotne aminokwas.
Białka mają podstawową lub pierwotną strukturę złożoną z łańcucha aminokwasowego zwanego łańcuchem polipeptydowym, w tych łańcuchach każdy aminokwas powstaje przez centralny węgiel zwany węglem α.
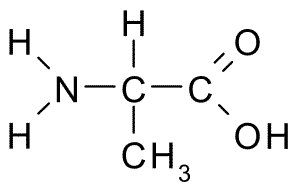
 Struktura chemiczna aminokwasu alaniny (źródło: Borb, Via Wikimedia Commons)
Struktura chemiczna aminokwasu alaniny (źródło: Borb, Via Wikimedia Commons) Węgiel α łączy cztery grupy: grupa aminowa (-NH2), grupa karboksylowa (-COH), atom wodoru (-H) i grupa lub łańcuch boczny (-R), który identyfikuje każdy aminokwasowy. W łańcuchu bocznym węgły sekwencyjnie biorą litery ß, γ, δ i ε.
Aminokwasy są klasyfikowane przez polaryzację ich łańcuchów bocznych, a zatem istnieją hydrofobowe i hydrofilowe aminokwasy polarne, które z kolei mogą być neutralne, podstawowe i kwaśne. Alanina jest hydrofobowym aminokwasem apolowym i jest najprostszym aminokwasem po glicynie i najliczniejszym w większości białek.
Alanina może być utworzona w mięśniu i przetransportowana do wątroby, gdzie jest wprowadzana do trasy glukoneogennej, to znaczy drogi do tworzenia glukozy z substancji nieglukozydowych. Alanina może być również syntetyzowana w wątrobie przez katabolizm tryptofanu i uracylu i może degradować w celu utworzenia pirogronianu.
Uczestniczyć w syntezie tryptofanu, pirydoksyny (witaminy B6) i mięsa.
Jest stosowany jako suplement diety w celu poprawy wydajności sportowej i naturalnie znajduje się w mięs krowie, wieprzowiny i ryb, a także w mleku, ich pochodnych i jajach. Niektóre rośliny strączkowe, owoce i orzechy są również bogate w Alanine.
[TOC]
Struktura
Wcześniej skomentowano, że alanina, podobnie jak wszystkie aminokwasy, ma węgiel α z czterema grupami zjednoczonymi z nim, będąc grupą metylową grupy R (-ch3).
Dlatego do ciała pH (około 7.4) węgiel α alaniny jest powiązany z grupą protonową aminową (-NH3+), z grupą karboksylową, która straciła proton (-co-), z wodorem i grupą metylową (-ch3).
Większość aminokwasów jest jonizowana do pH 7.0 i geometrycznie mogą mieć izomery, które są znane jako enancjomery, które są obrazami lustrzanymi, jak w przypadku prawej i lewej ręki.
Może ci służyć: histochemia: fundament, przetwarzanie, barwienieNastępnie wszystkie aminokwasy można znaleźć jako „pary chiralne” oznaczone jako D lub L (odpowiednio Dextro i Levo), zgodnie z położeniem atomów otaczających węgiel α α.
Jednak alanina, jak w przypadku większości aminokwasów.
Ten aminokwas można również znaleźć jako β-alanina, w której grupa aminowa jest przyłączona do jej węgla β, to znaczy do pierwszego węgla łańcucha bocznego.
Β-alanina występuje w kwasie pantotenowym (witamina B5) i niektórych naturalnych peptydach. D-alanina znajduje się w niektórych polipeptydach, które są częścią ścian niektórych komórek bakteryjnych.
Grupa R (Metilo, CH3)
Metyl łańcucha bocznego alaniny jest nasyconym węglowodorem, który nadaje apolarną hydrofobową charakterystykę dla tego aminokwasu. Ta cecha alaniny jest powszechna z innymi aminokwasami tej grupy, takimi jak glicyna, walina, leucyna i izoleucyna.
Aminokwasy, które składają się na grupę alifatycznych, są chemicznie neutralnymi aminokwasami i odgrywają bardzo ważną rolę w tworzeniu i utrzymaniu trójwymiarowej struktury białek, ponieważ mają tendencję do reagowania na siebie.
Te aminokwasy, w tym alanina, zawierają taką samą liczbę grup jonizowanych z przeciwnymi obciążeniami, więc nie mają obciążenia netto i są nazywane ”Zitecje ”.
Funkcje
Jako najbardziej znane aminokwasy, alanina jest stosowana w syntezie peptydów i białek w ogóle i uczestniczy w tworzeniu struktury polipeptydów i trzeciorzędowej struktury niektórych białek.
Inną z ważnych funkcji alaniny jest pośrednio uczestnictwo w kontroli glikemii:
Może powodować powstanie pirogronianu i odwrotnie, może również dotrzeć do wątroby i stać się glukozą poprzez glukoneogenezę, która ma być zauważana do krążenia lub zastosować w syntezie glikogenu, w razie potrzeby w razie potrzeby w razie potrzeby.
Alanina uczestniczy jako transporter amonu z mięśnia do wątroby, ponieważ może być zsyntetyzowana przez aminię z pirogronianu, transportem wątroby i transaminacja przez transaminację.
Dzieje się to jednocześnie z transformacją α-zotoglutaranu do glutaminianu, który może wejść do cyklu mocznika i stać się pirogronianem.
Inne funkcje
Ten aminokwas jest niezbędny do syntezy tryptofanu i pirydoksyny. Chociaż jest to chemicznie bardzo mało reaktywne, alanina może mieć rozpoznanie substratu i rozpoznawania regulacji enzymatycznej.
Może ci służyć: grupa parafiletycznaJedną z funkcji β-alaniny jest suplement diety, ponieważ jest ona stosowana jako ergogeniczna pomoc ćwiczeń. Spożycie β-alaniny zwiększa stężenie mięsistego (dipéptide utworzone przez β-alaninę i histydynę) w mięśniu szkieletowym, działając jako "bufor".
Zwykle mięsisty nie przyczynia się znacząco do całkowitej zdolności bufora komórek mięśniowych, co wynika to z niskiego stężenia. Podawanie β-alaniny zwiększa to stężenie, a zatem zdolność bufora, więc poprawia oporność poprzez zmniejszenie zmęczenia.
Biosynteza
Najważniejsza synteza alaniny w ludzkim ciele występuje przez redukcyjne amina. Ta reakcja wymaga jednego etapu enzymatycznego.
Pyrogronian zapewnia szkielet węglowy, a glutaminian zapewnia grupę aminową przenoszoną do pirogronianu. Enzym, który katalizuje tę odwracalną reakcję, jest transaminaza alanina.
W wyniku tej reakcji wytwarzane są alanina i α-papiertaran. Alanina może następnie być obecna w glukoneogenezie, glikolizy i w cyklu Krebsa.
Inne źródło alaniny pochodzi od degradacji tryptofanu do acetylo-CoA. Na tej trasie, gdy enzym enzymu chinureninazy na 3-hydroksykinurenie utworzy się 3-hydroksy antranien i alanina. Alanine zostaje wydana, a antranil 3-hydroksy podąża za trasą metaboliczną.
Degradacja uracylu jest kolejnym źródłem alaniny. W tym przypadku istnieje β-alanina, która może podążać kilkoma szlakami metabolicznymi, jednym z nich jest stać się acetylo-CoA.
Degradacja
Ogólny proces degradacji aminokwasów
Aminokwasy nie są przechowywane jako węglowodany i tłuszcze, więc te, które są uwalniane podczas degradacji białka, powinny być ponownie wykorzystywane do syntezy nowych białek i nukleotydów.
Z drugiej strony aminokwasy można degradować, a ich węglane szkielety mogą być stosowane w reakcjach katabolicznych lub anabolicznych.
Gdy aminokwasy są degradowane, nadmiar amoniaku azotu, który jest substancją toksyczną, którą należy wyeliminować, a pierwszym etapem degradacji aminokwasów jest eliminacja azotu.
U ssaków degradacja występuje w wątrobie; Tam cały aminokwas, który jest w nadmiarze i nie można go użyć, jest degradowany.
Degradacja alaniny
Degradacja alaniny występuje przez konwersję alaniny w pirogronian. Ta reakcja jest katalizowana przez transaminazę alaninę i wymaga obecności α-zotoglutaranu jako akceptora grupy aminowej, a następnie tworzenia glutaminianu; Jest to odwracalna reakcja.
Może ci służyć: czynniki wirulencjiTe reakcje tworzenia alaniny z degradacji pirogronianu i alaniny z tworzenia pirogronianu są częścią cyklu, który obejmuje mięśnie szkieletowe i wątrobę.
Wątroba przenosi glukozę do mięśni i mięśni, poprzez glikolizę, przekształca glukozę w pirogronian w celu wygenerowania ATP; Ten pirogronian może wejść do syntezy alaniny, którą można wlać do potoku krążenia i powraca do wątroby, która czyni go ponownie pirogronianem, który wchodzi w glukoneogenezę w celu utworzenia glukozy.
W razie potrzeby cykl jest powtarzany. W wątrobie produkcja pirogronianu z alaniny generuje jony amonu, które patrzą na glutaminę i glutaminian i wchodzą do cyklu mocznika. Następnie mocznik jest eliminowany przez mocz.
Alanina, glicyna, cysteina, serynowa i treonina są aminokwasami glikogennymi, ponieważ ich degradacja może powodować pirogronian, α-zetoglutaran, sukcynylo-CoA, fumaran lub oksalacetan, wszystkie glukoneogenne prekursory glukozy.
Pokarmy bogate w Alaninę
Głównymi źródłami aminokwasów są chude mięso, ryby, skorupiaki, jaja i produkty mleczne, jednak alanina znajduje się również w wielu produktach pochodzenia roślinnego. Przykładem pokarmów bogatych w Alaninę to:
- Mięso takie jak krowa, wieprzowina, owca, kurczak, indyk, królik, ryby; Jaja, mleko i pochodne.
- Suche owoce, takie jak orzechy laskowe, orzechy, kasztany, migdały i orzeszki ziemne, to źródła Alanina.
- Kokos, awokado, szparagi, bakłażan, maniok lub maniok, buraki, marchewka i słodkie ziemniaki.
- Rośliny strączkowe, takie jak kukurydza, fasola i groszek.
- Zbóż takie jak ryż, żyto, pszenica, kakao, owies i żyto.
Bibliografia
- Caruso, J., Charles, J., Unruh, k., Giebel, r., Learymonth, L., & Potter, w. (2012). Ergogenne działanie β-alaniny i karnozyny: proponowane przyszłe badania w celu kwantyfikacji skuteczności. Składniki odżywcze, 4(7), 585-601.
- Gille, c., Bölling, c., Hoppe, a., Bulik, s., Hoffmann, s., Hübner, k.,… Holzhütter, H. G. (2010). Hepatonet1: kompleksowa metaboliczna rekonstrukcja ludzkiego hepatocytów do analizy fizjologii wątroby. Biologia układów molekularnych, 6(411), 1-13.
- Mathews, c., Van Holde, K., & Ahern, K. (2000). Biochemia (3 wyd.). San Francisco, Kalifornia: Pearson.
- Murray, r., Bender, d., Botham, k., Kennelly, s. 1., Rodwell, v., I Weil, p. (2009). Ilustrowana biochemia Harpera (28. wyd.). McGraw-Hill Medical.
- Nelson, zm. L., & Cox, m. M. (2009). Zasady biochemii lehninger. Omega Editions (Ed.).
- « Przyczyny zanieczyszczenia elektromagnetycznego, konsekwencje
- Charakterystyka kwasu glutaminowego, funkcje, biosynteza »

