Struktura octanu amonu, właściwości, zastosowania i ryzyko

- 3817
- 743
- Eugenia Czapla
On Octan amonu Jest to sól nieorganiczna, której wzorem chemicznym jest NH4Ch3Cooh. Pochodzi od mieszaniny kwasu octowego, obecnej w occie komercyjnym do stężenia 5%, i amoniaku. Obie substancje początkowe mają charakterystyczne zapachy, więc można dowiedzieć się, dlaczego ta sól pachnie jak ocet-amonia.
Jednak najważniejszym najważniejszym z tej soli nie jest jej zapach, ale jej niskie temperaturę topnienia. Jest tak niski, że w każdym laboratorium można go było uzyskać w swojej ciekłej wersji, gdzie jony płyną swobodnie do transportu obciążeń elektrycznych.
 Kryształy octanu amonu. Źródło: Vidak [domena publiczna].
Kryształy octanu amonu. Źródło: Vidak [domena publiczna]. Z drugiej strony octan amonu jest pyszny; to znaczy wchłanianie wody lub wilgotności środowiska do momentu całkowitego rozpuszczenia. Właśnie dlatego, chociaż w stanie bezwodnym ich kryształy są białe, stają się szybko jasne (jak te w zlewce górnego obrazu).
Będąc solidnym źródłem amoniaku, musi być manipulowany w taki sposób, że wdychanie jego oparów jest zminimalizowane. Ale pomimo tej negatywnej cechy, NH4Ch3COOH jest przydatny do przygotowania roztworów buforowych, które utrzymuje żywność, podczas gdy jest składnikiem niektórych ekstraktorów białkowych rozpuszczalników.
[TOC]
Struktura octanu amonu
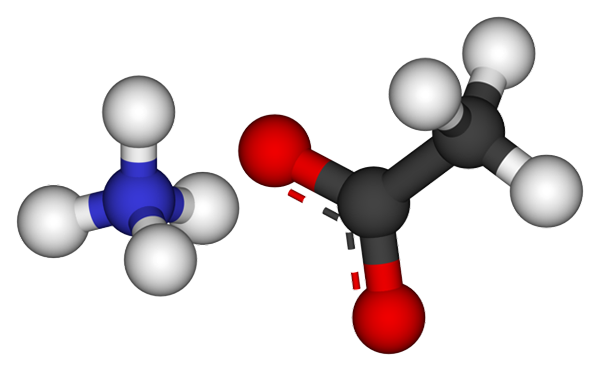 Jony octanu amonu. Źródło: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Jony octanu amonu. Źródło: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Górny obraz pokazuje jony, które składają się na octan amonu w modelu sfer i słupków. Po lewej stronie jest kation czworościennej, NH4+, Po prawej anion molekularny z dwoma demokowanym elektronami między dwoma atomami tlenu, CH3Gruchać- (Kropkowana linia między czerwonymi kulkami).
Zatem oba jony, NH4+ i rozdz3Gruchać-, Pozostają zjednoczeni z przyciąganiem elektrostatycznym, który wraz z odpychaniem między równymi obciążeniami ostatecznie definiują kryształ. Ten kryształ octanu amonu ma strukturę ortorombową, którą można zaobserwować w próbkach mikroskopowych lub nawet widzialnych rozmiarach.
Może ci służyć: link joniczny: Charakterystyka, sposób, w jaki jest tworzone i przykładyWiązanie jonowe dla tej soli jest nie tylko ważne, ale także mosty wodorowe. NH4+ Możesz przekazać darowiznę na cztery z tych mostów; To znaczy w każdym z wierzchołków jego tetrahedronu znajduje się atom tlenu z Cho3Gruchać- sąsiad (h3N+-H-Och3).
Teoretycznie siły wewnątrz ich kryształów powinny być bardzo silne; Ale eksperymentalnie występuje odwrotnie, ponieważ topi się tylko 114 ° C. Dlatego mosty wodorowe nie kompensują osłabienia ich wiązania jonowego ani niskiej energii siatkowej szkła nh4Ch3Gruchać.
Inne kompozycje i woda
Na początku powiedziano, że octan amonu jest przygotowywany przez zmieszanie kwasu octowego i kwasu amoniakowego. Dlatego sól można również wyrazić jako: NH3Ch3Cooh. Zatem w zależności od składu można uzyskać inne struktury: NH3· 2ch3Cooh, o nh3· 5ch3Na przykład Cooh.
Wspomniano również, że pochłania wystarczającą ilość wilgoci. W ten sposób zawiera cząsteczki wody do swoich kryształów, które są hydrolizowane, dając NH3 lub Ch3Cooh; I dlatego sól emituje zapach amoniaku lub octu.
Nieruchomości
Wygląd fizyczny
Delikatne białe kryształy z zapachem octu i amoniaku.
Masa cząsteczkowa
77 083 g/mol.
Gęstość
1073 g/ml w 25ºC.
Temperatura topnienia
114ºC. Ta wartość jest znacznie niższa w porównaniu z innymi solami lub związkami jonowymi. Ponadto brakuje mu temperatury wrzenia z powodu powstawania amoniaku, co sugeruje rozkład soli.
Rozpuszczalność
143 g/100 ml w 20ºC. Zwróć uwagę na swoją niezwykłą rozpuszczalność wody, która pokazuje powinowactwo, które cząsteczki wody odczuwają jony NH4+ i rozdz3Gruchać-, Hyting ich w wodnych sferach.
Może ci służyć: Hume-Rotherty RulesJego rozpuszczalność nie jest taka w mniej polarnych rozpuszczalnikach. Na przykład w 100 ml metanolu w 15 ° C 7,89 g rozpuszczenia NH4Ch3Gruchać.
Stabilność
Jest pyszny, więc należy unikać przechowywania w mokrych przestrzeniach. Ponadto, podczas wchłaniania wody uwalnia amoniaku, a zatem rozkłada się.
PKA
9.9.
Ta stała odpowiada kwasowości jonu amonu:
NH4+ + B NH3 + HB
Gdzie Hb jest słabym kwasem. Jeśli podstawą B jest woda, jej reakcja hydrolizy będzie reakcją:
NH4+ + H2Lub NH3 + H3ALBO+
W którym gatunku h3ALBO+ Zdefiniuj pH roztworu.
Z drugiej strony, octan przyczynia się również do pH:
Ch3Gruchać- + H2Lub Ch3Cooh + Oh-
Zatem oba gatunki h3ALBO+ I och- Są one zneutralizowane, dając pH 7, neutralne. Jednak według PubChem wysoce skoncentrowane roztwory octanu amonu mają kwaśne pH; co oznacza, że hydroliza NH dominuje4+ O wyborze3Gruchać-.
Standardowa entalpia treningowa
ΔFH298 = -615 kJ/mol.
Aplikacje
Analityczny
Wodne roztwory octanu sodu umożliwiają solubilizowanie ołowiu, żelaza i cynku, aby następnie określić ich stężenie przez spektroskopię absorpcji atomowej.
Pół kierowcy
Jako posiłki w niskiej temperaturze w porównaniu z innymi solami, jego ciecz może być użyta do napędzania prądu elektrycznego, który włącza obwód żarówki.
Bufor
Możesz regulować zmiany pH w odstępach kwaśnych lub podstawowych, które służy do utrzymania stałego pH, na przykład mięs, czekoladek, serów, warzyw lub innych produktów spożywczych.
Może ci służyć: molibdenumNa lodzie i podłogach
Jest to biodegradowalna i stosunkowo tania sól, używana do rozmrażania lodowych ścieżek. Ponadto, ponieważ jest źródłem rozpuszczalnego w wodzie azotu, jest przeznaczony do zastosowań rolniczych do oznaczania poziomów potasu.
Środek wytrących
Ta sól służy do wytrącania białka do przeprowadzenia analizy chromatograficznej.
Medycyna
Octan amonu działa jako weterynaryjny środek moczopędny, a także jest niezbędna sól do syntezy insuliny i penicyliny.
Ryzyko
Następnie i na koniec wymieniono pewne negatywne ryzyko lub konsekwencje spowodowane octanem amonu:
- Może powodować niewielkie podrażnienia na skórze, ale bez wchłaniania.
- Po spożywaniu powodują żołądek, biegunkę, diuresis, lęk, większą potrzebę oddawania moczu, drżenie i inne objawy związane z zatruciem amoniakiem, a także uszkodzenie wątroby.
- Jego wdychanie podrażnia nos, gardło i płuca.
Reszty nie wiadomo, czy rak może wygenerować, a wszelkie możliwe ryzyko pożaru przez tę sól jest odrzucane (przynajmniej w normalnych warunkach przechowywania).
Bibliografia
- Ining Nahringbauer. (1967). Badania wiązania wodorowego. Xiv. Struktura krystaliczna octanu amonu. Institute of Chemistry, University of Uppsala, Uppsala, Szwecja. Crysta Act. 23, 956.
- National Center for Biotechnology Information. (2019). Octan amonu. Baza danych Pubchem. CID = 517165. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Sullivan Randy. (2012). Przewodnictwo octanu amonu. Odzyskane z: chemdemos.Uoregon.Edu
- Viachem, Ltd. (S.F.). Octan amonu. Odzyskane z: viacheminc.com
- Wikipedia. (2019). Octan amonu. Źródło: w:.Wikipedia.org
- Departament Zdrowia w New Jersey. (2012). Octan amonu: arkusz informacji o niebezpiecznych substancjach. [PDF]. Odzyskane z: NJ.Gov
- Xueyanghu. (S.F.). Zastosowania i ryzyko octanu amonu. Odzyskane z: xueyanghu.WordPress.com
- « Charakterystyka alizaryny, przygotowanie, zastosowania i toksyczność
- Struktura wodorotlenku żelaza (iii) właściwości i zastosowania »

