Absorbancja, co jest, przykłady i ćwiczenia
- 3222
- 207
- Eugenia Czapla
Absorbancja Jest to logarytm z ujemnym znakiem ilorazu między wschodzącą intensywnością światła a intensywnością padania światła na próbce półprzezroczystego roztworu, który został oświetlony światłem monochromatycznym. Ten iloraz jest transmitancja.
Nazywa się fizyczny proces przejścia światła przez próbkę Lumowinous Transmission, A absorbancja jest jej miarą. Stąd absorbancja staje się najmniejszym logarytmem transmitancji i jest ważnym faktem do określenia stężenia próbki, która jest ogólnie rozpuszczona w rozpuszczalniku, takim jak woda, alkohol lub inna inna.
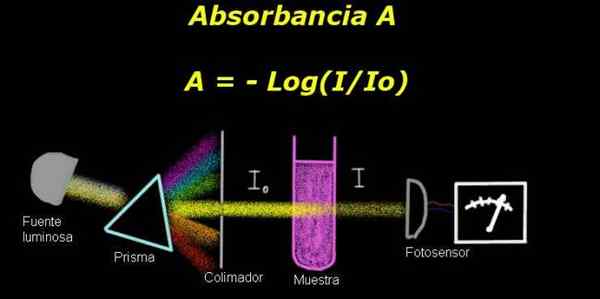
 Rysunek 1. Schemat procesu absorbancji. Przygotowane przez f. Zapata
Rysunek 1. Schemat procesu absorbancji. Przygotowane przez f. Zapata Aby zmierzyć absorbancję, wymagane jest urządzenie Electro-fotometr, z którym mierzony jest prąd, który jest proporcjonalny do incydentu z świetlistą intensywnością.
Podczas obliczania transmitancji sygnał intensywności odpowiadający samemu rozpuszczalnikowi jest ogólnie mierzony Io.
Następnie umieszczono próbkę rozpuszczoną w rozpuszczalniku z tymi samymi warunkami oświetlenia. Miara mierzona za pomocą elektrootometru jest oznaczona jako Siema, co pozwala obliczyć transmitancję T Zgodnie z następującym formułem:
T = i / ialbo
Jest to ilość uwolniona. Absorbancja a Jest to wyrażone jako:
A = - log (t) = - log (i / ialbo)
[TOC]
Absorbancja molowa i pochłanianie
Cząsteczki, które składają się na chemikalia, są w stanie wchłonąć światło, a miarą tego jest dokładnie absorbancja. Jest wynikiem interakcji między fotonami i elektronami molekularnymi.
Dlatego jest to wielkość, która będzie zależeć od gęstości lub stężenia cząsteczek, które tworzą próbkę, a także od ścieżki optycznej lub odległości przebywającej przez światło.
Możesz Ci służyć: trzecie prawo Newtona: aplikacje, eksperymenty i ćwiczeniaDane eksperymentalne wskazują, że absorbancja DO jest liniowo proporcjonalny do stężenia C i odległość D Światło podróżowało. Aby obliczyć go na podstawie tych parametrów, można ustalić następujący wzór:
A = ε⋅C⋅D
W poprzednim formule, ε Jest to stała proporcjonalności znana pod nazwą Absorbowanie molowe.
Absorbracja molowa zależy od rodzaju substancji i długości fali, z którą mierzona jest absorbancja. Absorbowanie molowe Jest również wrażliwy na temperaturę próbki i pH tego samego.
Prawo piwa-lambert
Ten związek między absorbancją, pochłanianiem, stężeniem i odległością od grubości ścieżki, którą światło podąża w próbce, jest znana jako prawo piwa-lambert.
 Rysunek 2. Prawo piwa - Lambert. Źródło: f. Zapata,
Rysunek 2. Prawo piwa - Lambert. Źródło: f. Zapata, Poniżej znajduje się kilka przykładów tego, jak z niego korzystać.
Przykłady
Przykład 1
Podczas eksperymentu próbka z czerwonym światłem lamp laserowych helu, których długość fali wynosi 633 nm. Elektro-fotometr mierzy 30 mV, gdy światło laserowe wpływa bezpośrednio na 10 mV, gdy przechodzi przez próbkę.
W takim przypadku przekazanie wynosi:
T = I / IO = 10 mV / 30 mv = ⅓.
A absorbancja to:
A = - log (⅓) = log (3) = 0,48
Przykład 2
Jeśli ta sama substancja jest umieszczona w pojemniku, który ma połowę grubego.
Należy wziąć pod uwagę, że jeśli grubość spada do połowy, wówczas absorbancja proporcjonalna do grubości optycznej zmniejsza się o połowę, to znaczy A = 0,28. Ton transmitancji będzie podawany przez następującą relację:
Może ci służyć: ujęcie pionowe: wzory, równania, przykładyT = 10-a = 10^(-0.28) = 0,53
Electro-fotometr zaznaczy 0,53*30 mV = 15,74 mV.
Rozwiązane ćwiczenia
Ćwiczenie 1
Wymagane jest określenie pochłaniania molowego pewnego opatentowanego związku, który jest w roztworze. W tym celu roztwór z światłem z lampy sodowej 589 nm jest oświetlony. Próbka zostanie umieszczona na grubości 1,50 cm.
Opiera się na roztworze stężenia 4,00 × 10^-4 moli na litr, a transmitancja mierzy się, powodując 0,06. Określ za pomocą tych danych Absorbota trzonowa próbki.
Rozwiązanie
Po pierwsze, określa się absorbancja, która jest definiowana jako najmniej logarytm oparty na dziesięciu transmitancji:
A = - log (t)
A = - log (0,06) = 1,22
Następnie stosuje się prawo Lambert-Beer, które ustanawia związek między absorbancją, pochłanianiem molowym, stężeniem i długością optyczną:
A = ε⋅C⋅D
Oczyszczanie pochłaniania trzonowego Uzyskuje się następujący związek:
ε = a/(c⋅d)
zastąpienie podanych wartości:
ε = 1,22/(4,00 × 10^-4 m⋅1,5 cm) = 2030 (M⋅CM)^-1
Poprzedni wynik został zaokrąglony do trzech znaczących cyfr.
Ćwiczenie 2
Aby poprawić dokładność i określić błąd pomiaru pochłaniania molowego próbki w ćwiczeniu 1, próbka jest sukcesywnie rozcieńczona w połowie stężenia, a transmitancja jest mierzona w każdym przypadku.
Zaczynając od CO = 4 × 10^-4 m z transmitancją t = 0,06 Uzyskuje się następującą sekwencję danych dla transmitancji i absorbancji obliczonej na podstawie transmitancji:
Co/1-> 0,06-> 1,22
Co/2-> 0,25-> 0,60
CO/4-> 0,50-> 0,30
Co/8-> 0,71-> 0,15
Co/16-> 0,83-> 0,08
Co/32-> 0,93-> 0,03
CO/64-> 0,95-> 0,02
Co/128-> 0,98-> 0,01
Co/256-> 0,99-> 0,00
Z tymi danymi zrób:
Może ci służyć: fale stacjonarne: wzory, cechy, typy, przykładya) Wykres absorbancji oparty na stężeniu.
b) liniowa regulacja danych i znajdź nachylenie.
c) Z uzyskanego nachylenia oblicz pochłanianie trzonowe.
Rozwiązanie
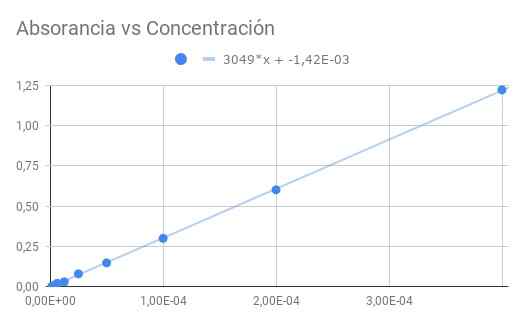 Rysunek 3. Absorbancja vs stężenie. Źródło: f. Zapata.
Rysunek 3. Absorbancja vs stężenie. Źródło: f. Zapata. Otrzymane nachylenie jest iloczynem chłonności molowej przez odległość optyczną, więc dzieląc nachylenie przez długość 1,5 cm
ε = 3049/1,50 = 2033 (M⋅CM)^-1
Ćwiczenie 3
Z danymi z ćwiczenia 2:
a) Oblicz chłonność dla każdego danych.
b) Określ średnią wartość absorbalności molowej, odchylenie standardowe i błąd statystyczny związany ze średnią.
Rozwiązanie
Absorbowanie molowe oblicza się dla każdego z testowanych stężeń. Przypomnij sobie, że warunki oświetlenia i odległość optyczna pozostają stałe.
Wyniki dla pochłaniania trzonowego to:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1 872, 1862 w jednostkach 1/(m*cm).
Z tych wyników możemy przyjąć średnią wartość:
= 1998 (m*cm)^-1
Ze standardowym odchyleniem: 184 (m*cm)^-1
Średni błąd jest odchyleniem standardowym podzielonym przez pierwiastek kwadratowy numeru danych, to znaczy:
Δ = 184/9^0,5 = 60 (m*cm)^-1
Wreszcie stwierdzono, że opatentowana substancja ma molowe pochłanianie przy częstotliwości 589 nm wytwarzanej przez lampę sodową:
= (2000 ± 60) (m*cm)^-1
Bibliografia
- Atkins, str. 1999. Chemia fizyczna. Omega Editions. 460-462.
- Przewodnik. Transmitancja i absorbancja. Odzyskane z: chemii.Laguia2000.com
- Toksykologia środowiskowa. Transmitancja, absorbancja i prawo Lamberta. Odzyskane z: repozytorium.Innovationumh.Jest
- Fizyka przygodowa. Absorbancja i transmitancja. Odzyskane z: rpfisica.Blogspot.com
- Sistofotometria. Odzyskane z: chem.Librettexts.org
- Toksykologia środowiskowa. Transmitancja, absorbancja i prawo Lamberta. Odzyskane z: repozytorium.Innovationumh.Jest
- Wikipedia. Absorbancja. Odzyskane z: Wikipedia.com
- Wikipedia. Spektrofotometria. Odzyskane z: Wikipedia.com
- « Kontekst latynoamerykańskiej awangardy -garde, cechy, autorzy
- Pochodzenie totalitaryzmu, cechy, przyczyny i konsekwencje »

