Historia jod, właściwości, struktura, uzyskiwanie, ryzyko, zastosowania

- 4383
- 236
- Arkady Sawicki
On jod Jest to reaktywny nie -metalowy element, który należy do grupy 17 tabeli okresowej (halogeny) i jest reprezentowany przez symbol chemiczny i. Zasadniczo jest to dobrze znany element na poziomie popularnym, od wody jodowanej, po hormon tyrozynowy.
W stanie stałym jod jest ciemnoszary z metalicznym połyskiem (niższy obraz), zdolny do sublimacji do wyprodukowania fioletowej pary, która po kondensacji na zimnej powierzchni pozostawia ciemną resztę. Liczne i atrakcyjne były eksperymenty w celu wykazania tych cech.
 Solidne kryształy jodu. Źródło: Bungee [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Solidne kryształy jodu. Źródło: Bungee [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Element ten został po raz pierwszy wyizolowany przez Bernard Curtois w roku 1811, przy jednoczesnym uzyskaniu związków, które służyły jako surowiec do produkcji Salepeter. Jednak Curtois nie zidentyfikował jodu jako elementu, zasług podzielenia Josepha Gay-Lussaca i Humphry'ego Davy'ego. Gay-Lussac zidentyfikował ten element jako „Iode”, termin pochodzący z greckiego słowa „ioides”, z którym wyznaczony był kolor fioletowy.
Elementarny jod, podobnie jak inne halogeny, jest cząsteczką dwuatomiczną, utworzoną przez dwa atomy jodu zjednoczone przez kowalencyjne wiązanie. Interakcja van der Waalsa między cząsteczkami jodu jest najsilniejsza wśród halogenów. To wyjaśnia, dlaczego jod jest halogenem z najwyższymi punktami topnienia i wrzenia. Ponadto jest to najmniej odczynnikowy halogenów, a ten z mniejszą elektroonicznością.
Jod jest niezbędnym elementem, który wymaga spożycia, ponieważ jest konieczny do wzrostu ciała; Rozwój mózgu i umysłowy; Metabolizm ogólnie, itp., Zalecanie dziennego spożycia 110 µg/dzień.
Niedobór jodu w stanie płodu danej osoby wiąże się z pojawieniem się kretynizmu, stanu charakteryzującego się spowolnieniem wzrostu ciała; a także niewystarczający rozwój psychiczny i intelektualny, odejście itp.
Tymczasem niedobór jodu w każdym wieku jednostki wiąże się z pojawieniem się woreczki, charakteryzującego się przerostem tarczycy. Wole jest chorobą endemiczną, ponieważ ogranicza się do niektórych obszarów geograficznych o własnych cechach żywności.
[TOC]
Historia
Odkrycie
Jod został odkryty przez francuskiego chemika Bernarda Curtois w roku 1811, pracując z ojcem przy produkcji Salitre, wymagając go węglanu sodu.
Ten związek został wyizolowany z wodorostów, które zebrano na wybrzeżu Normandii i Bretanii. W tym celu glony spalono, a prochy przemyto wodą, niszcząc powstałe odpady dodaniem kwasu siarkowego.
Pewnego razu, być może z powodu przypadkowego błędu, Curtois dodał nadmiar kwasu siarkowego i powstała fioletowa para, która krystalizowała na zimnych powierzchniach, osadzając się jako ciemne kryształy. Curtois podejrzewał, że był w obecności nowego elementu i nazwał go „substancją x”.
Curtois odkrył, że ta substancja po zmieszaniu z amoniakiem tworzy brązowe stałe (azot triacuro), który wykorzystał minimalny kontakt.
Jednak Curtois miał ograniczenia, aby kontynuować badania i postanowił dostarczyć oznaki swojej substancji Charlesowi DeSormesowi, Nicolasowi Clémentowi, Josephowi Gay-Lussacowi i André-Marie Ampère, aby uzyskać swoją współpracę.
Pojawienie się nazwy
W listopadzie 1813 r. Desormes and Clément upublicznił odkrycie Curtois. W grudniu tego samego roku Gay-Lussac powiedział, że nowa substancja może być nowym elementem, sugerując nazwę „Iodu” od greckiego słowa „ioides”, wyznaczonego dla fioletu.
Sir Humphry Davy, który otrzymał część próbki dostarczonej do Ampère przez Curtois, przeprowadził eksperymenty z próbką i zauważył podobieństwo do chloru. W grudniu 1813 r. Royal Society of London uczestniczył w identyfikacji nowego elementu.
Chociaż powstał argument między gejowskim-lessackiem i Davy'em o identyfikację jodu, oboje uznało, że Curtois jako pierwszy go wyizolował. W 1839 r. Final Curtois.
Zastosowania historyczne
W 1839 r. Louis Daguerre podał jodowi swoje pierwsze użycie komercyjne, według wynalezienia metody tworzenia zdjęć fotograficznych zwanych daguerreotypami, w cienkich arkuszach metalu.
W 1905 roku amerykański patolog David Marine zbadał niedobór jodu w niektórych chorobach i zalecił swoje spożycie.
Fizyczne i chemiczne właściwości
Wygląd
 Sublimacja kryształów jodowych. Źródło: Ershova Elizaweta [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Sublimacja kryształów jodowych. Źródło: Ershova Elizaweta [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Ciemnoszary metalowy połysk. Kiedy sublimuje opary, są to fioletowe zabarwienie (obraz doskonały).
Standardowa masa atomowa
126 904 u
Liczba atomowa (z)
53
Temperatura topnienia
113,7 ° C
Punkt wrzenia
184,3 ºC
Gęstość
Temperatura otoczenia: 4933 g/cm3
Rozpuszczalność
W wodzie rozpuszcza się, powodując brązowe roztwory stężenia od 0,03% do 20 ° C.
Ta rozpuszczalność wzrasta znacznie, jeśli wcześniej rozpuszczone jony jodku, ponieważ ustalono równowagę między I- i ja2 Aby utworzyć gatunki anionowe i3-, który jest rozwiązany lepiej niż jod.
W rozpuszczalnikach organicznych, takich jak chloroform, tetrachlorek węgla i dwusiarczki węgla, rozpuszcza jod, co daje fioletowe zabarwienie. Rozpuszcza się również w związkach azotu, takich jak pirydyna, chinolina i amoniak, z ponownym utworzeniem brązowego roztworu.
Różnica w zabarwienia polega na tym, że jod jest rozpuszczany jako cząsteczki solwatowane i2, lub jako kompleksy transferowe obciążenia; Te ostatnie pojawiają się, gdy zajmują się.
Może ci służyć: siarcze sodu (NA2S)Zapach
Akr, irytujący i charakterystyczny. Próg zapachu: 90 mg/m3 i irytujący próg zapachu: 20 mg/m3.
Współczynnik podziału oktanol/wodę
Log p = 2.49
Rozkład
Kiedy jest podgrzewany do rozkładu, emituje dym jodku wodoru i kilka związków jodku.
Breja
2,27 CP przy 116 ° C
Potrójny punkt
386,65 K i 121 kPa
Punkt krytyczny
819 K i 11,7 MPa
Fusion Heat
15,52 kJ/mol
Ciepło parowe
41,57 kJ/mol
Pojemność kaloryczna trzonowa
54,44 J/(mol · k)
Ciśnienie pary
Jod ma umiarkowane ciśnienie pary, a gdy zawierany pojemnik jest otwarty, jest powoli sublimowany do fioletowej pary, drażniący dla oczu, nosa i gardła.
Liczby utleniania
Liczby utleniania jodu to: -1 (i-), +1 (i+), +3 (i3+), +4 (i4+), +5 (i5+), +6 (i6+) i +7 (i7+). We wszystkich soli jodku, jak przypadek ki, jod spełnia liczbę utleniania -1, ponieważ mamy anion i-.
Jod nabywa dodatnie liczby utleniania w połączeniu z bardziej elementami elektroonegatywnymi niż on; Na przykład w ich tlenkach (i2ALBO5 i ja4ALBO9) lub związki interhalogenowane (I-F, I-CL i I-BR).
Elektronialiczność
2.66 na skali Pauling
Energia jonizacji
Po pierwsze: 1.008,4 kJ/mol
Po drugie: 1.845 kJ/mol
Po trzecie: 3.180 kJ/mol
Przewodność cieplna
0,449 W/(M · K)
Rezystancja
1,39 · 107 Ω · m do 0 ° C
Zakon magnetyczny
Diamagnetyczny
Reaktywność
Jod jest łączony z większością metali z tworzeniem jodków, a także z elementami niemetalicznymi, takimi jak fosfor i inne halogeny. Jon jodku jest silnym środkiem redukującym, który spontanicznie uwalnia elektron. Utlenianie jodku wytwarza brązowawy barw jodu.
Jod, przeciwny jodek, jest słabym środkiem utleniającym; słabsze niż brom, chlor i fluor.
Jod z numerem utleniania +1 można połączyć z innymi halogenami z liczbą utleniania -1, aby powstrzymać halogendy jodu; Na przykład: jod bromek. Jest również połączony z wodorem, aby powodować jodek wodoru, który po rozpuszczeniu w wodzie nazywa się kwasem irydowym.
Kwas jodhorryczny jest bardzo silnym kwasem zdolnym do tworzenia jodków poprzez reakcję metali lub ich tlenków, wodorotlenków i węglanów. Jod ma stan utleniania +5 w kwasie jodowym (Hio3), który jest odwodniony w celu wytwarzania pentlesyku jodu (i2ALBO5).
Struktura elektroniczna i konfiguracja
- Atom jodu i ich linki
 Cząsteczka dwuatomiczna jodu. Źródło: Benjah-BMM27 przez Wikipedia.
Cząsteczka dwuatomiczna jodu. Źródło: Benjah-BMM27 przez Wikipedia. Jod w stanie podstawowym składa się z atomu, który ma siedem elektronów walencji, tylko jeden z możliwości uzupełnienia oktetu i stania się izolektronicznego z szlachetnym gazem ksenonowym. Te siedem elektronów jest ułożone na orbitale 5s i 5p zgodnie z ich konfiguracją elektroniczną:
[Kr] 4d10 5s2 5 p5
Dlatego atomy pokazują silną tendencję do łączenia kowalencyjnego, aby każdy z nich indywidualnie miał osiem elektronów w swojej najbardziej zewnętrznej warstwie. Zatem dwa atomy I zbliżam się i tworzą łącznik I-i, który definiuje cząsteczkę dwuatomiczną I2 (doskonały obraz); Jednostka molekularna jodu w trzech stanach fizycznych w normalnych warunkach.
Na obrazie obserwuje się cząsteczkę I2 reprezentowany przez model wypełniania przestrzeni. Jest to nie tylko cząsteczka dwuatomiczna, ale także homonuklearna i apolarna; Tak więc jego interakcje międzycząsteczkowe (i2 - Siema2) Rządzą londyńskimi siłami dyspersji, które są bezpośrednio proporcjonalne do ich masy cząsteczkowej i wielkości atomu.
Ten link I-i jest jednak słabszy w porównaniu z innymi halogenami (F-F, Cl-Cl i Br-Br). Wynika to teoretycznie z biednym nakładaniem3.
- Kryształy
Masa cząsteczkowa I2 Pozwala jego siłom dyspersyjnym wystarczająco kierunkowe i silne, aby ustalić szkło ortorombowe pod ciśnieniem otoczenia. Jego wysoka zawartość elektronów sprawia, że światło promuje symfiny przejściowe energii, które wytwarza kryształy jodowe.
Jednak kiedy jod sublimuje opary, wykazują fioletowe zabarwienie. Wskazuje to już na bardziej specyficzne przejście w obrębie orbitali molekularnych I2 (Osoby z większą energią lub antienlacją).
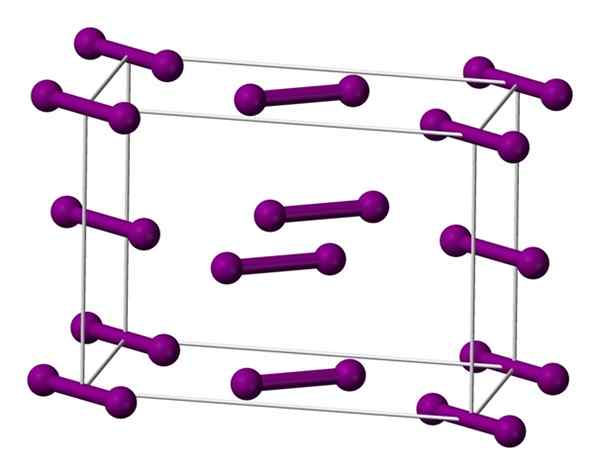 Jednolitowa komórka ortorombowa wyśrodkowana na podstawie kryształu jodu. Źródło: Benjah-BMM27 [domena publiczna].
Jednolitowa komórka ortorombowa wyśrodkowana na podstawie kryształu jodu. Źródło: Benjah-BMM27 [domena publiczna]. Cząsteczki I pokazano powyżej2, reprezentowany przez model sfer i prętów, uporządkowany w komórce ortorrombieskiej.
Można zaobserwować, że istnieją dwie warstwy: z poniższych z pięcioma cząsteczkami i medium z czterema. Zauważ, że cząsteczka jodu znajduje się u podstawy komórki. Kryształ jest okresowo konstruowany warstwami w trzech wymiarach.
Podróż w kierunku równolegle do linków I-i, okazuje się, że orbitale jodu nakładają się na generowanie pasma napędzającego, który powraca do tego elementu półprzewodnikowego; Jednak jego zdolność do prowadzenia energii elektrycznej znika, jeśli kierunek prostopadły do warstw jest przestrzegany.
Odległości łącza
Wydaje się, że link I-i został opóźniony; I w rzeczywistości jest tak, ponieważ długość jego łącza wzrasta z 266 pm (stan gazowy), 272 pm (stan stały).
Może to wynikać z faktu, że w gazie cząsteczki i2 Są bardzo dystansowani, a ich siły międzycząsteczkowe są prawie nieistotne; Podczas stałego siły te (i-i-i-i) stają się namacalne, przyciągając atomy jodu dwóch sąsiednich cząsteczek wobec siebie i zgodnie z odległością międzycząsteczkową (lub międzyatomiczną, w przeciwnym razie).
Może ci służyć: związek chemii z innymi naukamiNastępnie, gdy sublimalne szkło jodowe, obligacja I-i kurczy się w fazie gazowej, ponieważ sąsiednie cząsteczki nie wywierają już tej samej siły przyciągania (dyspersyjnej) na jego otoczenie. A także logicznie, odległość i2 - Siema2 wzrasta.
- Fazy
Wspomniano powyżej, że łącze I-i jest słabsze w porównaniu z innymi halogenami. W fazie gazowej w temperaturze 575 ° C, 1% cząsteczek I2 Rozpadają się z indywidualnymi i atomami. Jest tyle energii cieplnej, że tylko dwa i ponownie są oddzielone i tak dalej.
Podobnie, to zerwanie linków może wystąpić, jeśli zastosowano ogromne naciski na kryształy jodu. Podczas ścigania go zbytnio (pod ciśnieniem setki tysięcy razy wyższych niż atmosferyczne), cząsteczki I2 Zostają one przełożone jako faza monoatomiczna I, a następnie mówi się, że jod wykazuje charakterystykę metalu.
Istnieją jednak inne fazy krystaliczne, takie jak: Orthrome skoncentrowany na ciele.
Gdzie to jest i uzyskaj
Jod ma proporcję wagi, w odniesieniu do skorupy ziemskiej, 0,46 ppm, zajmującym miejsce 61 w obfitości. Minerały Yoduro są rzadkie, a depozyty jodu, które są komercyjnie wykorzystujące.
Minerały jodu znajdują się w skałach magmowych o stężeniu 0,02 mg/kg przy 1,2 mg/kg oraz w skałach magmowych o stężeniu 0,02 mg przy 1,9 mg/kg. Można go również znaleźć w Kimmeridge Lutita, ze stężeniem 17 mg/kg masy.
Ponadto minerały jodowe występują w skałach fosforanowych o stężeniu od 0,8 do 130 mg/kg. Woda morska ma stężenie jodu, które waha się od 0,1 do 18 µg/l. Glony, gąbki i ostrygi morskie były wcześniej głównymi źródłami jodu.
Jednak głównymi źródłami są kaliche, złoża azotanu sodu na pustyni Atacama (Chile) i Salmuelas, głównie z japońskiego pola gazowego w Minami Kanto, na wschód od Tokio i basenu gazowego Anadarko w Oklahomie (USA (USA ).
Kaliche
Jod jest ekstrahowany z jodinus caliche i jest leczony bisulfitem sodu, aby zmniejszyć go do jodku. Następnie roztwór reaguje z nowo wyodrębnionym yodato, aby ułatwić jego filtrację. Kaliche był głównym źródłem jodu w XIX i na początku XX wieku.
Solanka
Po jego oczyszczeniu solanka traktuje się kwasem siarkowym, który wytwarza jodek.
Ten roztwór jodku reaguje następnie z chlorem, wytwarzając rozcieńczony roztwór jodu, który odparowuje za pomocą prądu powietrza, który jest odchylony od chłonnej wieży dwutlenku siarki, powodując następującą reakcję:
Siema2 + 2 godz2Lub +SO2 => 2 hi +h2południowy zachód4
Następnie gaz jodku wodoru reaguje z chlorem, aby uwolnić jod w stanie gazowym:
2 hi +cl2 => I2 + 2 HCl
I wreszcie filtry jodu, oczyszcza i opakowani do użycia.
Artykuł biologiczny
- Zalecana dieta
Jod jest niezbędnym elementem, ponieważ interweniuje w licznych funkcjach w żywych istotach, które są szczególnie znane u ludzi. Jedynym sposobem wejścia jodu do człowieka są żywność, którą spożywa.
Zalecana dieta jodowa różni się w zależności od wieku. Zatem 6 -miesięczny chłopiec wymaga spożycia 110 µg/dzień; Ale od 14 roku życia zalecana dieta wynosi 150 µg/dzień. Ponadto zauważa się, że spożycie jodu nie powinno przekraczać 1.100 µg/dzień.
- Hormony tarczycy
Hormon stymulujący tarczycę (TSH) jest wydzielany przez przysadkę i stymuluje jod z pęcherzykami tarczycy. Jod jest przenoszony wewnątrz pęcherzyków tarczycy, zwanych koloidami, gdzie wiąże się z aminokwasem tyrozyny z tworzeniem monoyodotyrozyny i diodototyrozyny.
W koloidu pęcherzyku monoyodirozyna3). Z drugiej strony można połączyć dwie cząsteczki diodotyrozyny, tworząc tetrarydotyron (t4). T3 oraz T4 Są tak zwanymi hormonami tarczycy.
Hormony t3 oraz T4 Są one wydzielane z osoczem, gdzie wiążą się z białkami osocza; Wśród nich przenośnik białka hormonów tarczycy (TBG). Większość hormonów tarczycy jest transportowana w osoczu jako t4.
Jednak aktywna forma hormonów tarczycy wynosi t3, Więc t4 W „białych narządach” hormonów tarczycy, doświadczenia i przekształca się w t3 Aby wykonać hormonalne działanie.
Efekty
Efekty działania hormonów tarczycy są wielokrotne, możliwe wskazanie: wzrost metabolizmu i syntezy białek; promocja wzrostu ciała i rozwoju mózgu; Zwiększone ciśnienie krwi i tętno itp.
- Niedobór
Niedobór jodu, a zatem hormonów tarczycy, znany jako niedoczynność tarczycy, ma wiele konsekwencji, na które wpływa wiek osoby.
Jeśli niedobór jodu wystąpi w stanie płodu, najbardziej istotną konsekwencją jest kreatynizm. Ten warunek charakteryzuje się oznakami takimi jak pogorszenie funkcji umysłowych, opóźnienie w rozwoju fizycznym, strudyzm i późne dojrzewanie seksualne.
Może ci służyć: miedź: historia, właściwości, struktura, zastosowania, papier biologicznyNiedobór jodu może wywołać wola, niezależnie od wieku, w którym występuje niedobór. Wole to nadmierny rozwój tarczycy, spowodowany nadmierną stymulacją gruczołu przez hormon TSH, uwalniany z przysadki mózgowej w wyniku niedoboru jodu.
Nadmierny rozmiar tarczycy (wola) może ściskać tchawicę, ograniczając przez niego przejście powietrza. Ponadto może powodować uszkodzenie nerwów krtaniowych, które mogą mieć w rezultacie rum.
Ryzyko
Zatrucie z powodu nadmiernego spożycia jodu może powodować oparzenia w ustach, gardle i gorączce. Także ból brzucha, nudności, wymioty, biegunka, słaby puls i śpiączka.
Nadmiar jodu powoduje niektóre objawy zaobserwowane w niedoborze: istnieje hamowanie syntezy hormonów tarczycy, więc uwalnianie TSH wzrasta, co powoduje przerost tarczycy; to znaczy wole.
Istnieją badania wskazujące, że nadmierne spożycie jodu może powodować raka brodawkowatego tarczycy. Ponadto nadmierne spożycie jodu może oddziaływać z lekami poprzez ograniczenie jego działania.
Nadmierne spożycie jodu za pomocą leków przeciwtarkudowych, takich jak metimazol, stosowane w leczeniu nadczynności tarczycy, może mieć addytywne działanie i powodować niedoczynność tarczycy.
Przekształcające angiotensynę (ECA) inhibitory enzymów, takie jak Benazepril, stosuje się w leczeniu nadciśnienia. Przyjmowanie nadmiernej ilości jodku potasowego zwiększa ryzyko hiperkaliemii i nadciśnienia.
Aplikacje
Lekarze
Jod działa jak dezynfekujący skórę lub rany. Ma prawie migawkę działanie przeciwdrobnoustrojowe, penetrując mikroorganizmy i oddziałuje z aminokwasami siarki, nukleotydami i kwasami tłuszczowymi, co powoduje śmierć komórki.
Wywiera swoje działanie przeciwwirusowe zasadniczo na objęte wirusy, postulując się, która atakuje powierzchnię zadanych wirusów.
Jodek potasu w skoncentrowanym roztworze jest stosowany w leczeniu tyreotoksykozy. Jest również stosowany do kontrolowania skutków promieniowania 131I podczas blokowania związku radioaktywnego izotopu na tarczycę.
Jod stosuje się w leczeniu dendrytycznego zapalenia rogówki. W tym celu narażona jest rogówka do oparów nasyconej wody z jodem, nabłonek rogówki tymczasowo przegrywa; Ale jest całkowitym odzyskaniem tego w ciągu dwóch lub trzech dni.
Jod ma również korzystny wpływ na leczenie zwłóknienia zatoki ludzkiej. Podobnie wskazano, że 131Mógłbym być opcjonalnym leczeniem raka tarczycy.
Reakcje i działanie katalityczne
Jod służy do wykrywania obecności skrobi, co daje niebieskie zabarwienie. Reakcja jodu ze skrobią służy również do wykrywania obecności fałszywych biletów wydrukowanych na papierze zawierającym skrobię.
Tetrayodomercurate potasu (II), znane również jako Nessler Reagent, jest stosowany w wykrywaniu amoniaku. Podobnie w teście jodoformu stosuje się roztwór alkaliczny, aby pokazać obecność metylocetoniowej.
Nieorganiczny jodek. Na etapie procesu należy utworzyć tetrayoduros tych metali.
Jod służy jako stabilizator Colfonia, oleju i innych produktów drewnianych.
Jod jest stosowany jako katalizator w reakcjach syntezy organicznej metylacji, izomeryzacji i odwodnienia. Tymczasem kwas iarchlorinowy jest stosowany jako katalizator produkcji kwasu octowego w procesach Monsanto i Cativa.
Jod działa jak katalizator kondensacji i alpozycji aromatycznych amin, a także w procesach sulfatyzacji i siarków oraz do produkcji syntetycznych gumów.
Fotografia i optyka
Silver Yoduro jest niezbędnym elementem tradycyjnego filmu fotograficznego. Jod stosuje się w produkcji instrumentów elektronicznych, takich jak unikalne szklane pryzmaty, polaryzacyjne instrumenty optyczne i szkło zdolne do transmitowania promieni podczerwieniowych.
Inne zastosowania
Jod stosuje się w opracowywaniu pestycydów, anilin i barwników ftaleína. Ponadto jest stosowany w syntezie barwników i jest środkiem gasiącym dym. I wreszcie srebrny jodek służy jako rdzeń kondensacji pary wodnej w chmurach, aby spowodować deszcz.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Stuart Ira Fox. (2003). Ludzka psychologia. Pierwsza edycja. Edytować. McGraw-Hill Inter-American
- Wikipedia. (2019). Jod. Źródło: w:.Wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi i Onoda Mitsuko. (2003). Modulowany strupowanie stałego jodu podczas dysocjacji cząsteczkowej STI. Nature Volume 423, strony971-974. doi.Org/10.1038/Nature01724
- Chen l. i in. (1994). Przejścia fazy strukturalnej jodu pod wysokim ciśnieniem. Institute of Physics, Sinica Academy, Pekin. doi.Org/10.1088/0256-307x/11/2/2010
- Stefan Schneider i Karl Christe. (26 sierpnia 2019). Jod. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Dr. Doug Stewart. (2019). Fakty elementów jodu. Chemicool. Odzyskane z: Chemicool.com
- National Center for Biotechnology Information. (2019). Jod. Baza danych Pubchem. CID = 807. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Rohner, f., Zimmermann, m., Jooste, s. 1., Pandav, c., Caldwell, k., Raghavan, r., & Raiten, D. J. (2014). Biomarkery żywieniowe do przeglądu rozwoju joda. The Journal of Nutrition, 144 (8), 1322S-1342S. Doi: 10.3945/jn.113.181974
- Advameg. (2019). Jod. Wyjaśniono chemię. Odzyskane z: chemistryrexplaed.com
- Traci Pedersen. (19 kwietnia 2017 r.). Fakty o jodzie. Odzyskane z: Livescience.com
- Megan Ware, RDN, LD. (30 maja 2017 r.). Wszystko, co musisz wiedzieć o jodzie. Odzyskany z: MedicalNewstody.com
- National Institute of Health. (9 lipca 2019 r.). Jod. Źródło: SDG.Od.Nih.Gov
- « Historia Kripton, właściwości, struktura, uzyskiwanie, ryzyko, użycia
- Mary Celeste poprzedniki, wydarzenia, teorie »

