Potasu yodato (KIO3)
- 4635
- 21
- Arkady Sawicki
Co to jest jod potasowy?
Yodato potasu lub potasu Jodato jest nieorganicznym związkiem jodowym, w szczególności sól, której chemiczna wzór to Kio3. Jod lub jod, element grupy halogenowej (F, Cl, Br, I, As), ma w tej soli liczbę utleniania +5; Właśnie dlatego jest to silny środek utleniający. Kio3 Dysocjuje w wodnym pożywce, aby stworzyć jony k+ i io3-.
Jest syntetyzowany przez reakcję wodorotlenku potasu z kwasem jodowym: Hio3(aq) + koh (s) => kio3(aq) + h2Lub (l). Można go również syntetyzować poprzez reakcję jodu molekularnego z wodorotlenkiem potasu: 3i2(s)+6KOH (s) => kio3(aq) + 5KI (aq) + 3H2Lub (l).
Właściwości jodato potasu
 Wygląd Yodato potasu
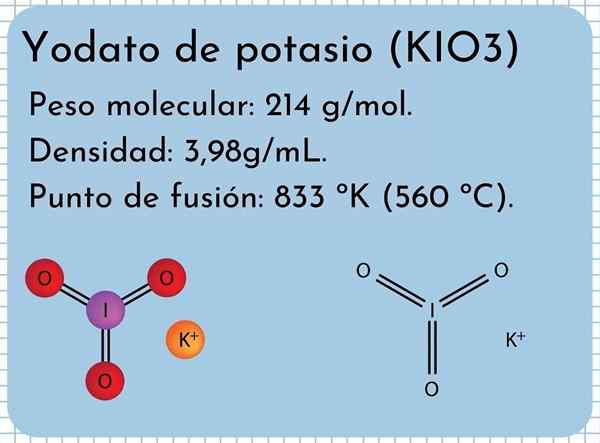
Wygląd Yodato potasu Jest to bezwonne białe, stałe, drobne kryształy i z monokliniczną strukturą krystaliczną. Ma gęstość 3,98 g/ml, masę cząsteczkową 214 g/mol i przedstawia pasma absorpcji w widmie podczerwieni (IR).
Ma punkt topnienia: 833 ° K (560 ° C), składający się z silnych interakcji jonowych między jami+ i io3-. W wyższych temperaturach reakcja rozkładu termicznego, uwalniająca tlen cząsteczkowy i jodek potasu:
2Kio3(s) => 2KI (s) + 3o2(G)
W wodzie ma rozpuszczalność, która waha się od 4,74 g/100 ml do 0 ° C, do 32,3 g/100 ml w 100 °. Ponadto jest nierozpuszczalny w alkoholu i kwasie azotowym, ale jest rozpuszczalny w rozcieńczonym kwasie siarkowym.
Jego powinowactwo do wody nie jest znaczące, co wyjaśnia, dlaczego nie jest higroskopijna i nie istnieje w postaci uwodnionych soli (Kio3· H2ALBO).
Środek utleniający
Yodato potasu, jak wskazuje jego wzór chemiczny, ma trzy atomy tlenu. Jest to silnie elektroonegatywne elementy i ze względu na tę właściwość pozostawia „odkrycie” niedoboru chmury elektronicznej otaczającej jod.
Może ci służyć: gazy obojętneTen niedobór lub wkład, w zależności od przypadku - można obliczyć jako liczbę utleniania jodu (± 1, +2, +3, +5, +7), wynoszącą +5 w przypadku tego soli.
Co to znaczy? Że zanim gatunek zdolny do podania elektronów, jod zaakceptuje je w formie jonowej (IO3-) stać się molekularnym jodem i mieć liczbę utleniania równą 0.
Po tym wyjaśnieniu można ustalić, że jodek potasu jest związkiem utleniającym, który intensywnie reaguje z czynnikami redukującymi w wielu reakcjach redoks; Z tego wszystkiego jest znany jako zegar jodu.
Zegar jodu składa się z procesu redoks powolnych i szybkich kroków, w którym szybkie kroki są oznaczone roztworem Kio3 W kwasie siarkowym, do którego dodaje się skrobia. Następnie skrobia -wytworzona i zakotwiczona wśród jego struktury gatunek i3-- Będzie to kolorowe niebieskie roztwór na ciemnoniebieski.
Io3- + 3 HSO3- → i- + 3 HSO4-
Io3- + 5 i- + 6 godz+ → 3 i2 + 3 godz2ALBO
Siema2 + Hso3- + H2O → 2 i- + Hso4- + 2 godz+ (ciemnoniebieski z powodu skrobi)
Struktura chemiczna
 Struktura Yodato potasu
Struktura Yodato potasu Na górnym obrazie zilustrowano strukturę chemiczną jodu potasu. IO anion3- Jest reprezentowany przez „statyw” czerwonych i fioletowych kul, a jony k+ Są reprezentowane przez fioletowe kule.
Ale co oznaczają te statywy? Prawidłowe geometryczne kształty tych anionów to faktycznie trygonalne piramidy, w których tlen składa się na trójkątną podstawę, oraz nieposiszny moment obrotowy punktów jodu na górę, zajmującą przestrzeń i zmuszając do składania linku I-O i dwa łącza i = o = o.
Może ci służyć: kwas tatarowyTa geometria molekularna odpowiada hybrydyzacji SP3 centralnego atomu jodu; Jednak inna perspektywa sugeruje, że jeden z atomów tlenu tworzy powiązania z orbitalami „D” jodu, faktycznie jako hybrydyzacja typu SP3D2 (Jod może mieć swoje orbitale „D” rozszerzające warstwę Walencji).
Kryształy tej soli mogą ponieść przejścia fazy strukturalnej (inne ustalenia inne niż monokliniczne) w wyniku różnych warunków fizycznych, które je poddają.
Zastosowania i zastosowania jodu potasu
Zastosowanie terapeutyczne
Yodato potasu jest zwykle stosowane w celu uniknięcia akumulacji radioaktywności w tarczycy w postaci 131Ja, gdy ten izotop jest używany do określania jodu przez tarczycę jako składnik działania tarczycy.
Podobnie, jodato potasu jest stosowane jako miejscowe antyseptyczne (0,5 %) w błonach śluzowych.
Używać w przemyśle
Jest dodawany do pokarmu zwierząt hodowlanych jako suplement jodu. Dlatego w branży jest stosowany w branży potasu w celu poprawy jakości mąki.
Zastosowanie analityczne
W chemii analitycznej, dzięki swojej stabilności, jest stosowany jako główny wzór w standaryzacji wzorów tiosiarczanu sodu (na2S2ALBO3), w celu ustalenia stężeń jodu w problemach.
Oznacza to, że ilości jodu mogą być znane technikami objętościowymi (stopnie). W tej reakcji jony potasowe utlenia się na jony jodku I-, Poprzez następujące równanie chemiczne:
Może ci służyć: octan ołowiu: struktura, właściwości, uzyskiwanie, użyciaIo3- + 5i- + 6h+ => 3i2 + 3H2ALBO
Jod, ja2, jest zatytułowany z rozwiązaniem Na2S2ALBO3 dla jego standaryzacji.
Stosować w technologii laserowej
Badania wykazały i potwierdziły interesujące właściwości piezoelektryczne, piroelektryczne, elektrooptyczne, ferroelektryczne i nieliniowe optyki3. Powoduje to ogromny potencjał w dziedzinie elektronicznej i technologii laserów dla materiałów wykonanych z tym związkiem.
Zagrożenia dla zdrowia jodełka potasu
W wysokich dawkach może powodować podrażnienia w błonie śluzowej jamy ustnej, skóry, oczu i dróg oddechowych.
Eksperymenty toksyczności jodatu potasu u zwierząt pozwoliły nam zaobserwować, że u psów w szybkich dawkach 0,2-0,25 g/kg masy ciała, dostarczone doustnie.
Jeśli unika się tych wymiotów, u zwierząt wytwarza pogorszenie ich sytuacji, ponieważ indukowana jest anoreksja i przed śmiercią. Jego autopsje pozwoliły na obserwowanie martwiczych zmian w wątrobie, nerkach i błonie śluzowej jelitowej.
Ze względu na swoją moc utleniającą, reprezentuje ryzyko pożaru, gdy wchodzi w kontakt z łatwopalnymi materiałami.
Bibliografia
- Dzień, r., & Underwood, a. Ilościowa chemia analityczna (Ed.). Pearson Prentice Hall, P-364.
- Chemikalia. (2017). Jodat potasu. Pobrano 25 marca 2018 r. Z Chemicalbook: Chemicalbook.com
- Pubchem. (2018). Jodat potasu. Pobrano 25 marca 2018 r. Z Pubchem: Pubchem.NCBI.NLM.Nih.Gov
- Merck. (2018). Potasu yodato. Pobrano 25 marca 2018 r. Z Merck:
- MerckMillipore.com
- M M Abdel Kader i in. (2013). Mechanizm transportu ładunku i przejścia fazy niskiej temperatury w Kio3. J. Phys.: Conf. Być. 423 012036

